
科目: 来源: 题型:选择题
| A. | 手持试管给试管内的物质加热 | |
| B. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| C. | 用天平称量药品时用手直接拿砝码 | |
| D. | 用滴管滴加液体时滴管应垂直悬垂在容器上方且不能触及容器内壁 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.1 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 如图表示一个电解池,装有电解质溶液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解质溶液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目: 来源: 题型:解答题
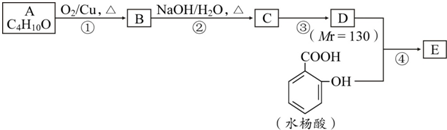

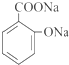
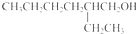 .
.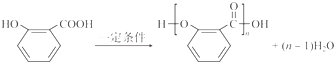 .
.
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4 L氯水含有NA个Cl2分子 | |
| B. | 在1 L 0.1 mol•L-1碳酸钠溶液中阴离子总数大于0.1NA | |
| C. | 50 mL18.4 mol•L-1浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA | |
| D. | 标准状况下,由H2O2制得4.48 LO2转移的电子数目为0.8NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铁的冶炼过程是通过置换反应得到单质铁 | |
| B. | 太阳能电池可采用硅材料制作,其应用有利于环保、节能 | |
| C. | 化学家采用玛瑙研钵磨擦固体反应物进行溶剂合成,玛瑙的主要成分是硅酸盐 | |
| D. | 包装食品里常有硅胶、生石灰、还原铁粉三类小包,其作用相同 |
查看答案和解析>>
科目: 来源: 题型:解答题
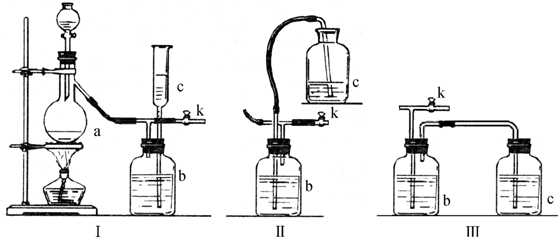
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
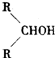 最难
最难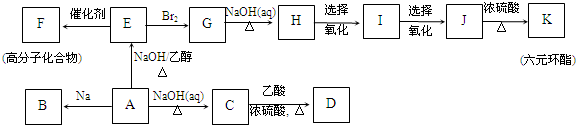
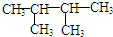 ,K为
,K为 ;
;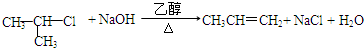 ;G→H
;G→H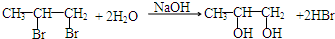 ;
;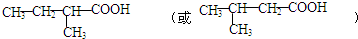 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com