
科目: 来源: 题型:选择题
| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ | |
| B. | 在溶液中滴加盐酸酸化,在滴加硝酸钡溶液,若有白色沉淀生成则含有SO42- | |
| C. | 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+ | |
| D. | 将气体通入澄清石灰水,溶液变浑浊,证明原气体可能是CO2 |
查看答案和解析>>
科目: 来源: 题型:解答题


 .
. 、
、 .
.查看答案和解析>>
科目: 来源: 题型:解答题
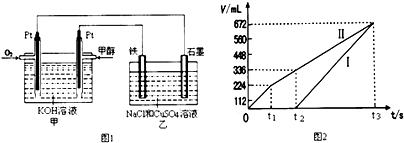
查看答案和解析>>
科目: 来源: 题型:解答题
 如图所示,甲、乙两池的电极材料都是铁棒与碳棒,丙池是电解精炼铜.
如图所示,甲、乙两池的电极材料都是铁棒与碳棒,丙池是电解精炼铜.查看答案和解析>>
科目: 来源: 题型:选择题
 298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )
298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )| A. | 正极反应为:Zn-2e-→Zn2+ | B. | 盐桥中K+向右池移动 | ||
| C. | Pt电极上有气泡出现 | D. | 左烧杯中溶液的红色变浅 |
查看答案和解析>>
科目: 来源: 题型:选择题
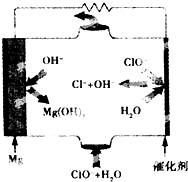 镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )| A. | 池总反应式为Mg+ClO-+H2O=Mg(OH)2↓+Cl- | |
| B. | 正极反应式为ClO-+H2O+2e-=Cl-+2OH- | |
| C. | 该燃料电池中镁为负极,发生还原反应电 | |
| D. | 放电过程中OH-移向负极 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 (10-10m) | 0.73 | 1.02 | 1.34 | 1.06 | 0.99 | 1.54 | 0.75 | 1.18 |
| 最高或最 低化合价 | +6 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -2 | -3 | -1 | -3 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用水润湿的pH试纸来测量溶液的pH | |
| B. | 实验需要480mL 2.0mol•L-1的氢氧化钠溶液.配制该溶液时先称量氢氧化钠固体38.4g,然后再按照溶解、冷却、移液、洗涤、定容、摇匀的步骤进行操作 | |
| C. | 向溶液中滴加硝酸酸化的Ba(NO3)2溶液出现白色沉淀,说明溶液中一定有SO42- | |
| D. | 用溴水,淀粉、KI溶液比较Br2与I2的氧化性强弱,所需玻璃仪器主要有:试管、胶头滴管 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com