
科目: 来源: 题型:解答题
 在如图所示的容积相同的三个容器①②③中进行如下反应:3A(g)+B(g)?2C(g)△H<0,若起始温度相同,分别向三个容器中充入6mol A和2mol B,则达到平衡时各容器中C物质的百分含量由大到小的顺序为③②①(填容器编号).
在如图所示的容积相同的三个容器①②③中进行如下反应:3A(g)+B(g)?2C(g)△H<0,若起始温度相同,分别向三个容器中充入6mol A和2mol B,则达到平衡时各容器中C物质的百分含量由大到小的顺序为③②①(填容器编号).查看答案和解析>>
科目: 来源: 题型:选择题
| A. | K值越大,表明该反应速率越快,反应物的转化率也越大 | |
| B. | 若缩小反应器的容积,能使平衡正向移动,则K增大 | |
| C. | 温度相同,K值也一定相同 | |
| D. | pC(g)?mA(g)+nB(g) 的平衡常数与K互为相反数 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 环境问题 | 造成环境问题的主要物质 |
| 温室效应 | |
| 酸雨 | |
| 南极臭氧层空洞 | |
| 光化学烟雾 |
查看答案和解析>>
科目: 来源: 题型:解答题
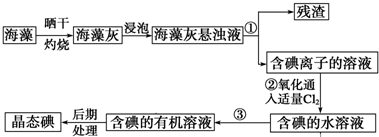
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
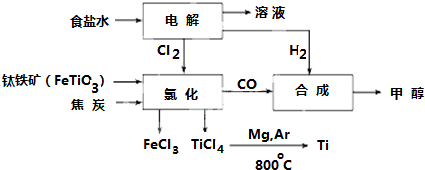
查看答案和解析>>
科目: 来源: 题型:解答题
 镍及其化合物常用作合金、催化剂及电极材料.已知:镍元素有+2、+3价的氧化物和氢氧化物,在盐中以+2价的形式存在.
镍及其化合物常用作合金、催化剂及电极材料.已知:镍元素有+2、+3价的氧化物和氢氧化物,在盐中以+2价的形式存在.
| 沉淀 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com