
科目: 来源: 题型:选择题
| A. | 硫酸钡难溶于水,在水溶液中不能导电,所以硫酸钡不是电解质 | |
| B. | 强电解质在水溶液中的导电性一定比弱电解质强 | |
| C. | 三氧化硫溶于水能导电,所以三氧化硫是电解质 | |
| D. | 硫酸、氢氧化钡、纯碱、苛性钠都是强电解质 |
查看答案和解析>>
科目: 来源: 题型:解答题
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①②③④ | C. | ①②④ | D. | ③④⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在101kPa时,1mol C与适量O2反应生成1mol CO时,放出110.5kJ热量,则C的燃烧热为110.5kJ/mol | |
| B. | 在10lkPa时lmol H2完全燃烧生成液态水放出285.8kJ热量,H2燃烧热为-285.8KJ/mol | |
| C. | 鉴定HCl和NaOH反应的中和热时,每次实验均应测量3个温度即盐酸起始温度、NaOH起始温度和反应后终止温度 | |
| D. | 在稀溶液中:H+(aq)+oH-(aq)═H2O(l)△H=-57.3KJ/mol,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3KJ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题


| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目: 来源: 题型:解答题
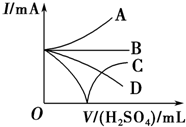 向Ba(OH)2溶液中加入稀硫酸,请完成下列问题:
向Ba(OH)2溶液中加入稀硫酸,请完成下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 通丙烷的电极为电池负极,发生的电极反应为:C3H8-20e-+10O2-═3CO2+4H2O | |
| B. | 该电池的总反应是:C3H8+5O2═3CO2+4H2O | |
| C. | 电路中每通过5mol电子,约有5.6L标准状况下的丙烷被完全氧化 | |
| D. | 在熔融电解质中,O2-由负极移向正极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com