
科目: 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 氯化镁溶液与氨水反应:Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+ | |
| D. | 氧化铝溶于NaOH溶液:Al2O3+2OH-+3H2O═2Al(OH)3 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 该电池与硅太阳能电池供电原理相同 | |
| B. | 光照时,b极周围pH减小 | |
| C. | 光照时,H+由b极室透过质子膜进入a极室 | |
| D. | 夜间无光照时,a为电池的负极 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 离子 | 离子浓度(mol•L-1) | |
| 还原前 | 还原后 | |
| SO42- | 3.20 | 3.50 |
| Fe2+ | 0.15 | 3.30 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
 常温下,向20mL 0.2mol.L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中1代表H2A,II代表HA-,III代表A2-).根据图示判断,下列说法正确的( )
常温下,向20mL 0.2mol.L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中1代表H2A,II代表HA-,III代表A2-).根据图示判断,下列说法正确的( )| A. | 欲使NaHA溶液里中性,可以向其中加入酸或碱 | |
| B. | 向NaHA溶液加入水的过程中,pH可能增大也可能减小 | |
| C. | 当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②③④ | B. | ②③④⑥ | C. | ①②③④⑥ | D. | 各组均符合 |
查看答案和解析>>
科目: 来源: 题型:选择题
 室温下,将0.1mol•L-1盐酸滴入20mL 0.1mol•L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示.下列有关说法不正确的是( )
室温下,将0.1mol•L-1盐酸滴入20mL 0.1mol•L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示.下列有关说法不正确的是( )| A. | a点的pH>7,但Kw仍为1.0×10-14 | |
| B. | b点所示溶液中C(Cl-)=C(NH4+) | |
| C. | C点溶液pH<7,其原因是NH4++H2O?NH3•H2O+H+ | |
| D. | d点所示溶液中离子浓度由大到小的排序是:c(Cl-)>C(NH4+)>C(H+)>C(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将CO2通入BaCl2溶液中至饱和,无沉淀产生,再通入SO2,产生白色沉淀 | |
| B. | 已知CuS和FeS都难溶于水,将H2S分别通入CuCl2和FeCl2溶液,都会产生沉淀 | |
| C. | 向AlCl3溶液中滴加NaHCO3溶液,产生白色沉淀;再加入NaHSO4溶液,沉淀可消失 | |
| D. | 形状基本一样的纯净锌块和含铜、铁等杂质的锌块分别与相同浓度的稀硫酸反应纯净的锌块反应产生氢气的速率快 |
查看答案和解析>>
科目: 来源: 题型:选择题
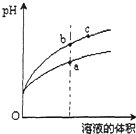 某温度下,相同pH的盐酸和醋酸分别加水稀释,pH随溶液体积变化的曲线如图所示,据图判断下列说法正确的是( )
某温度下,相同pH的盐酸和醋酸分别加水稀释,pH随溶液体积变化的曲线如图所示,据图判断下列说法正确的是( )| A. | b点酸的总浓度大于a点酸的总浓度 | |
| B. | c点溶液的导电性比b点强 | |
| C. | a点Kw的数值比c点溶液的Kw的数值大 | |
| D. | b点水电离产生的c(H+)比a点大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com