
科目: 来源: 题型:选择题
| 选项 | 操作或现象 | 实验目的 |
| A | 将铁钉放入试管中,用盐酸浸没 | 验证铁的吸氧腐蚀 |
| B | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 | 证明Br-还原性强于Cl- |
| C | 将氯化亚铁固体溶于适量蒸馏水中 | 配制FeCl2溶液 |
| D | 将混有氯化氢杂质的氯气通过装有饱和NaHCO3溶液的洗气瓶 | 除去氯气中的HCl气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 用试管加热碳酸氢钠固体时使试管口竖直向上 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 少量金属汞洒落在实验室地面或桌面时,应立即向汞上撒硫黄粉,然后再清扫 |
查看答案和解析>>
科目: 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| 体系 | c(SO2) mol/L | c(O2) mol/L | c(SO3) mol/L | 浓度商 |
| (1) | 0.0600 | 0.400 | 2.000 | 不填 |
| (2) | 0.0960 | 0.300 | 0.500 | 不填 |
| (3) | 0.0862 | 0.263 | 1.020 | 不填 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 一定是酸性溶液 | B. | 一定是碱性溶液 | ||
| C. | 可能是中性溶液 | D. | 可能是酸性溶液也可能是碱性溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
 (1)下列物质中:A.NaCl(s) B.蔗糖(s) C.SO2(g) D.KNO3(熔融)
(1)下列物质中:A.NaCl(s) B.蔗糖(s) C.SO2(g) D.KNO3(熔融)| CH3COOH | H2CO3 | H2S | H3PO4 |
| K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分别与足量CaCO3反应时,放出的CO2一样多 | |
| B. | 与NaOH完全中和时,醋酸所消耗的NaOH多 | |
| C. | 两种溶液的pH相等 | |
| D. | 取等体积盐酸和CH3COOH溶液,分别加水稀释a倍和b倍,溶液的pH相等,则a<b |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 高温下铁与水蒸气反应生成保护膜:2Fe+6H2O(g)═2Fe(OH)3+3H2 | |
| B. | 向新制的氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | |
| C. | 盛放氢氧化钠溶液的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O | |
| D. | 向氯化铝溶液中加入过量的氢氧化钠溶液:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目: 来源: 题型:填空题
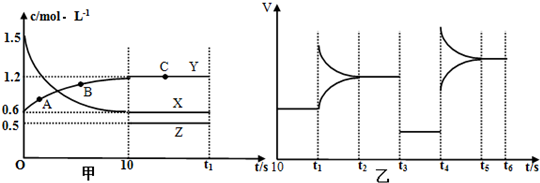
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com