
科目: 来源: 题型:选择题

| A. | CO和N2为等电子体,22.4 L的CO气体与l mol N2所含的电子数相等 | |
| B. | 在2.4 g石墨中,含C-C共价键数目为0.3NA | |
| C. | 720 g C60晶体含有0.25NA个晶胞(晶胞如图) | |
| D. | 1mol[Cu(NH3)4]2+中含配位键4 NA |
查看答案和解析>>
科目: 来源: 题型:解答题
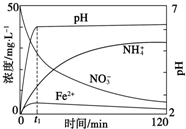 工、农业废水及生活污水中浓度较高的NO${\;}_{3}^{-}$会造成氮污染,工业上处理水体中NO${\;}_{3}^{-}$的一种方法是单质铁化学还原法.某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下.
工、农业废水及生活污水中浓度较高的NO${\;}_{3}^{-}$会造成氮污染,工业上处理水体中NO${\;}_{3}^{-}$的一种方法是单质铁化学还原法.某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 实验室制Cl2:MnO2+2H++2Cl-═Mn2++Cl2↑+2H2O | |
| B. | 用过量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2=2NH4++SO32-+H2O | |
| C. | 将铝片打磨后置于NaOH溶液中:2Al+2OH-=2AlO2-+H2↑ | |
| D. | 苯酚浊液与纯碱溶液混合后变澄清:2C6H5OH+CO32-=2C6H5O-+CO2↑+H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验1 | 常温时取四种金属少量分别放入装有蒸馏水的试管中 |
| 实验2 | 再取少量铝、铁、铜分别放入装有稀硫酸的试管中 |
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 元素X、Y、Z、M、R均为短周期主族元素,且原子序数依次增大.已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4,且M原子的质子数是Y原子的2倍;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,请回答下列问题:
元素X、Y、Z、M、R均为短周期主族元素,且原子序数依次增大.已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4,且M原子的质子数是Y原子的2倍;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,请回答下列问题: .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 阳离子 | Na+、Ag+、Ca2+、Ba2+ |
| 阴离子 | NO3-、CO32-、SiO32-、SO42- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色胶状沉淀并放出标准状况下0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
查看答案和解析>>
科目: 来源: 题型:选择题
 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | 该装置工作时,b极发生还原反应 | |
| B. | 每生成1molO2,有44gCO2被还原 | |
| C. | 该装置工作时,H+从a极区通过质子交换膜向b极区迁移 | |
| D. | a电极的反应为:3CO2+18H++18e-═C3H8O+5H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  除去CO中的CO2 | |
| B. |  苯萃取碘水中的I2分出水层后的操作 | |
| C. |  配制0.10mol•L-1 NaOH溶液 | |
| D. |  记录滴定终点读数为12.20mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com