
科目: 来源: 题型:选择题
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 4s时c(B)为0.76mol/L | |
| B. | 830℃达平衡时,A的转化率为80% | |
| C. | 反应达平衡后,升高温度,平衡正向移动 | |
| D. | 1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为0.4 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 某同学配制98mL 3.0mol•L-1 NaOH溶液的实验步骤如下:
某同学配制98mL 3.0mol•L-1 NaOH溶液的实验步骤如下:查看答案和解析>>
科目: 来源: 题型:解答题
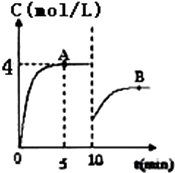 在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol•L-1和b mol•L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.
在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol•L-1和b mol•L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 催化剂只改变正反应速率的速率 | |
| B. | 催化剂能够改变反应的反应热 | |
| C. | 催化剂能改变反应物的转化率 | |
| D. | 催化剂通过降低反应的活化能来加快反应速率 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 摩尔是物质的数量单位 | |
| B. | 58.5 gNaCl溶解在1 L水中,得到溶液的物质的量浓度为1mol/L | |
| C. | 标况下,1 mol CCl4 所占的体积约为22.4 L | |
| D. | 12g12C含有的碳原子数约为6.02×1023个 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验序号 | 操作及现象 |
| ⅰ | 取2mL 0.1mol/L FeCl3溶液,滴入3滴0.1mol/L KSCN溶液,溶液变为红色,通入一段时间O2,无明显变化.再加入3滴 1mol/L H2O2溶液,红色很快褪去. |
| ⅱ | 取少量ⅰ中所得溶液滴加入BaCl2溶液,产生白色沉淀,加入盐酸,沉淀不溶解. |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com