
科目: 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目: 来源: 题型:解答题

 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 烧杯中的溶液没有恢复到室温就转移到容量瓶,一定会导致结果偏高 | |
| B. | 没有洗涤烧杯和玻璃棒,一定会导致结果偏低 | |
| C. | 容量瓶使用时没有干燥会导致结果偏低 | |
| D. | 使用量筒量取浓溶液后,没有把洗涤量筒得到洗涤液转移到容量瓶,会导致结果偏低 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 物质A、B的转化率之比一定是1:2 | |
| B. | 起始时刻和达平衡后容器中的压强比为1:1 | |
| C. | 若起始放入3molA和3molB,则达平衡时生成3amolC | |
| D. | 当v正(A)=v逆(C)时,可断定反应达到平衡 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 平衡向正反应方向移动了 | B. | A的转化率变大了 | ||
| C. | a<c+d | D. | △H值变大了 |
查看答案和解析>>
科目: 来源: 题型:解答题
| Fe2O3 | CO[ | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0] |
查看答案和解析>>
科目: 来源: 题型:解答题
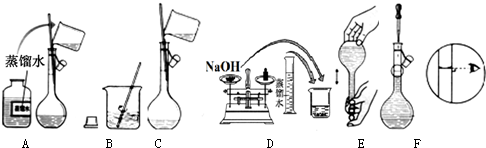
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 2Fe3++SO2+2H2O═2Fe2++SO42ˉ+4H+ | B. | Cl2+SO2+2H2O═H2SO4+2HCl | ||
| C. | 2 Fe3++2Cl-═2 Fe2++Cl2↑ | D. | 2 Fe2++I2═2 Fe3++2I- |
查看答案和解析>>
科目: 来源: 题型:填空题
| 物质的量/时间 | n(N2H4) | n(NO2) | n(N2) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.3 |
| 第5min | 0.4 | 1.2 | 0.6 |
| 第6min | 0.4 | 1.2 | 0.6 |
| 第10min | 0.6 | 1.4 | 0.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com