
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
 (1)如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.请根据装置回答下列问题:
(1)如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.请根据装置回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaHSO4 | B. | NH4Cl | C. | HCl | D. | Ba(OH)2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硝酸、纯碱、明矾和氧化铁分别属于酸、碱、盐和氧化物 | |
| B. | 氯化氢、氯气、二氧化氮溶于水都能导电,都是电解质 | |
| C. | 煤的气化、液化都是化学变化,可为人类提供清洁高效的燃料 | |
| D. | 氨水、醋、84消毒液中都存在电离平衡,它们都是弱电解质 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等物质的量浓度的FeBr2和CuCl2的混合液用惰性电极电解最初发生:Cu2++2Br-═Cu↓+Br2 | |
| B. | H218O中投入Na2O2:2H218O+2Na2O2═4Na++4OH-+18O2↑ | |
| C. | 向明矾溶液中逐滴加入Ba(OH)2溶液到SO42-恰好沉淀完全: 2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| D. | Fe(NO3)3的酸性溶液中通入足量硫化氢:2Fe3++H2S═2Fe2++S↓+2H+ |
查看答案和解析>>
科目: 来源: 题型:解答题
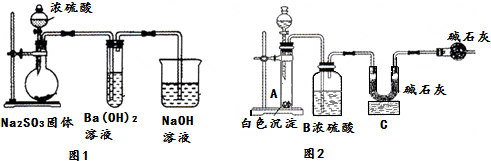
| 实验步骤 | 预期现象与结论 |
| 步骤1:用适量白色沉淀于试管中,加入少量蒸馏水,滴加几滴品红溶液 | 白色沉淀不溶解,溶液呈红色. |
| 步骤2:往上述试管中滴加足量稀盐酸,充分振荡. | 若沉淀部分溶解,则含有②. |
查看答案和解析>>
科目: 来源: 题型:解答题
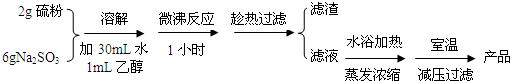
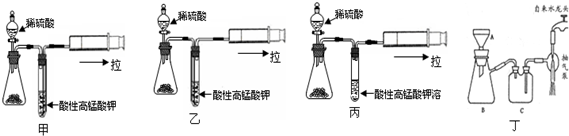
| 组号 | 反应温度(℃) | Na2S2O3 | H2O | H2SO4 | ||
| V/mL | c/mol•L-1 | V/mL | V/mL | c/mol•L-1 | ||
| ① | 10 | 10 | 0.1 | 0 | 10 | 0.1 |
| ② | 10 | 5 | 0.1 | 5 | 10 | 0.1 |
| ③ | 30 | 10 | 0.1 | 0 | 10 | 0.1 |
| ④ | 30 | 5 | 0.1 | 5 | 10 | 0.1 |

查看答案和解析>>
科目: 来源: 题型:选择题
 .下面有关PHB的说法不正确的是( )
.下面有关PHB的说法不正确的是( )| A. | PHB是高分子化合物 | |
| B. | 合成PHB的单体是CH3CH2CH(OH)COOH | |
| C. | 通过缩聚反应可以制得PHB | |
| D. | 在PHB的降解过程中一定没有氧气参加反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com