
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液中:K+、Cu2+、Cl-、MnO${\;}_{4}^{-}$、 | |
| B. | 滴入甲基橙显红色的溶液中:NH${\;}_{4}^{+}$、Ba2+、Al3+、CH3COO- | |
| C. | $\frac{{K}_{w}}{c({H}^{+})}$=10-130.1mol•L-1的溶液中:Fe3+、NH${\;}_{4}^{+}$、Mg2+、SO${\;}_{4}^{2-}$ | |
| D. | 能溶解Al2O3的溶液中:Mg2+、Fe3+、AlO${\;}_{2}^{-}$、HCO${\;}_{3}^{-}$ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
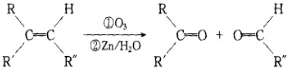
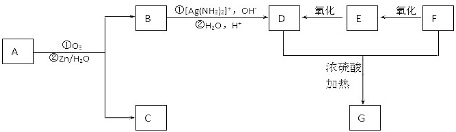
 +2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.
+2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 待提纯的物质 | 选用的试剂 | 操作的方法 |
| A | CaO(CaCO3) | 水 | 溶解、过滤、结晶 |
| B | Cu(CuO) | 稀盐酸 | 溶解、过滤、洗涤、干燥 |
| C | CuSO4(H2SO4) | 氢氧化钠溶液 | 过滤 |
| D | ZnSO4(CuSO4) | Zn(OH)2 | 溶解、过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
 甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:| 化学键 | H-H | C-O | C$\frac{\underline{\;←\;}}{\;}$O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 升高温度,H2S浓度增加,表明正反应是吸热反应 | |
| B. | 反应前H2S物质的量为7mol | |
| C. | 通入CO后,正反应速率逐渐增大,逆反应速率减小 | |
| D. | CO的平衡转化率为80% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②④⑤⑦⑧ | B. | ④⑤⑥⑦⑧ | C. | ②④⑥⑦⑧ | D. | 全部 |
查看答案和解析>>
科目: 来源: 题型:选择题
 在2L恒容密闭容器中充入2mol X和1mol Y发生反应:2X(g)+Y(g)?3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示.下列推断正确的是( )
在2L恒容密闭容器中充入2mol X和1mol Y发生反应:2X(g)+Y(g)?3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示.下列推断正确的是( )| A. | Q点时,Y的转化率最大 | |
| B. | 升高温度,平衡常数增大 | |
| C. | W点X的正反应速率等于M点X的正反应速率 | |
| D. | 平衡时充入Z,达到新平衡时Z的体积分数增大 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键 | |
| B. | CaF2晶体的晶胞如图2所示,Ca2+的配位数与F-的配位数之比为1:2 | |
| C. | 氢原子的电子云图如图3所示,表示一段时间内氢原子核外1个电子在空间出现的概率 | |
| D. | 金属Cu中铜原子堆积模型如图4,该金属晶体为面心立方最密堆积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com