
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

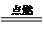 2FeCl3.
2FeCl3.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5.6 L | B. | 22.4 L | C. | 4.48 L | D. | 无法计算 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CF4 CBr4 CsCl SiO2 | B. | SiO2 CsCl CF4 CBr4 | ||
| C. | CsCl SiO2 CBr4 CF4 | D. | SiO2 CsCl CBr4 CF4 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
| 实验 编号 | HA的物质的量 浓度(mol/L) | NaOH的物质的 量浓度(mol/L) | 混合后 溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=8 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 平衡左移,容器内压强不一定增大 | |
| B. | 平衡右移,达到平衡时容器内压强一定增大 | |
| C. | 平衡右移,SO2的转化率提高 | |
| D. | 平衡不一定移动,容器内压强一定增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
 如图是425℃时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )
如图是425℃时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92kJ•mol-1 | |
| B. | 一定条件下N2+3H2═2NH3达到平衡时,3v正(H2)=2v逆(NH3) | |
| C. | 加入催化剂,该反应的反应热发生改变 | |
| D. | 温度、容器体积一定,通入1molN2和3molH2反应后放出的热量为Q1kJ,若通入2 molN2和6 molH2反应后放出的热量为Q2kJ,则有184>Q2>2Q1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com