
科目: 来源: 题型:选择题
| A. | 还原剂是HCl,氧化剂是MnO2 | |
| B. | 每生成1 mol Cl2,转移电子的物质的量为2 mol | |
| C. | 每消耗1 mol MnO2,起还原剂作用的HCl消耗4 mol | |
| D. | 转移电子的物质的量为1 mol时,生成标准状况下Cl2的体积为11.2 L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铬元素的化合价为+7价 | B. | 在检查时重铬酸钾发生氧化反应 | ||
| C. | 重铬酸钾具有强氧化性 | D. | 它由橙红色变为绿色是物理变化 |
查看答案和解析>>
科目: 来源: 题型:解答题
 碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:
碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
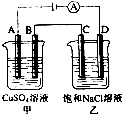 如图两个电解槽中,A、B、C、D均为石墨电极.若电解过程中共有0.02mol电子通过,下列叙述中不正确的是( )
如图两个电解槽中,A、B、C、D均为石墨电极.若电解过程中共有0.02mol电子通过,下列叙述中不正确的是( )| A. | 甲烧杯中B极上最多可析出铜0.64g | |
| B. | 甲烧杯中A极上电极反应式4OH--4 e-═2H2O+O2↑ | |
| C. | 烧杯中D极上电极反应式为4H++4 e-═2H2↑ | |
| D. | 乙烧杯中滴入酚酞试液,C极附近先变红 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 通氧气的电极为负极,发生还原反应 | |
| B. | 电池工作时,CO32-向正极移动 | |
| C. | 电池放电时,外电路电子由通氧气的正极流向通氢气的负极 | |
| D. | 负极的电极反应为:H2+CO32--2e-═CO2↑+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲烷的摩尔质量为16克 | |
| B. | 标准状况下,0.3molSO2中含氧原子数为0.3NA | |
| C. | 常温下,2.7克铝离子所带的电荷数为0.3NA | |
| D. | 常温下,9.5克MgCl2晶体中含Mg2+为0.2NA |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | KClO3是氧化剂 | |
| B. | 被氧化与被还原的氯元素的质量比为5:1 | |
| C. | H2SO4既不是氧化剂又不是还原剂 | |
| D. | 反应中KCl被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com