
科目: 来源: 题型:选择题
| A. | 氯水能够使石蕊试液变红后褪色,说明氯水中存在H+和漂白性物质 | |
| B. | 向上排空气法收集氯气可以用湿润的KI淀粉试纸是否变蓝检验是否收集满 | |
| C. | 氯水与明矾在自来水处理的过程中原理是不同的 | |
| D. | 实验室应用无色细口玻璃试剂瓶存放保存在煤油中的钠 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | (1)(3)(2)(5)(4) | B. | (1)(2)(3)(4)(5) | C. | (1)(5)(3)(2)(4) | D. | (1)(3)(5)(4)(2) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 胶体的分散质能透过滤纸 | |
| B. | 胶体能产生丁达尔现象 | |
| C. | 胶体是纯净物,其它分散系是混合物 | |
| D. | 胶体的分散质粒子直径在10-7~10-9m之间 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铁屑溶于过量稀硝酸:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| B. | Fe(OH)3溶于过量的HI溶液:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| C. | 在AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 过量的NaHSO4溶液与Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ①②③⑤ | D. | ①②③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 200mL0.10mol/LNaCl溶液 | B. | 200 mL 0.10mol/LBaCl2溶液 | ||
| C. | 200mL0.1mol/LKCl溶液 | D. | 100mL0.1mol/LAl2(SO4)3溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题

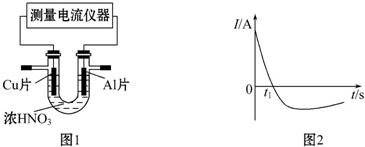
查看答案和解析>>
科目: 来源: 题型:解答题
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com