
科目: 来源: 题型:
下列实验不能达到预期目的是:( )
|
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 实验现象的解释及结论 |
| ①各取少量样品于A、B、C、D 4支试管中,加入足量NaOH浓溶液,加热. | 4支试管中均产生能使湿润的红色石蕊试纸变蓝的气体. | 4支试管中的样品都含有 NH4+ NH4+ 离子. |
| ②向4支试管中分别滴加BaCl2溶液. | 试管A、B中产生白色沉淀,C、D中无明显现象. | 产生白色沉淀的离子方程式是 Ba2++CO32-=BaCO3↓ Ba2++CO32-=BaCO3↓ ,Ba2++SO42-=BaSO4↓ Ba2++SO42-=BaSO4↓ . |
| ③继续向试管A、B中分别加入足量盐酸. | 试管A中沉淀溶解且产生无色气体;B中无明显变化. | 试管A中原样品为 (NH4)2CO3 (NH4)2CO3 ,试管B中原样品为 (NH4)2SO4 (NH4)2SO4 . |
| ④继续向试管C、D中分别加入足量硝酸酸化,再分别滴加AgNO3溶液. | 试管C、D中均有白色沉淀产生. | 无法鉴别试管C、D中的样品. |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 为探究氨气的一些性质,同学们做了以下两个实验.
为探究氨气的一些性质,同学们做了以下两个实验.
| ||
| ||
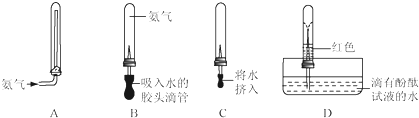
查看答案和解析>>
科目: 来源: 题型:
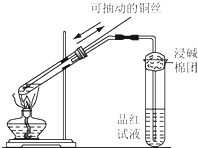 某同学用如图所示的装置进行铜与浓硫酸反应的实验.请回答问题.
某同学用如图所示的装置进行铜与浓硫酸反应的实验.请回答问题.
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
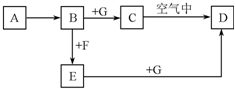 A~G是中学化学中常见的物质,在一定条件下它们之间的转化关系如图所示,其中A为金属,F是一种有毒的气体单质,G为NaOH溶液.
A~G是中学化学中常见的物质,在一定条件下它们之间的转化关系如图所示,其中A为金属,F是一种有毒的气体单质,G为NaOH溶液.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com