
科目: 来源: 题型:选择题
| A. | ③④ | B. | ①② | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4.2×10-10mol•L-1 | B. | 8.4×10-10mol•L-1 | ||
| C. | 3.1×10-10mol•L-1 | D. | 5.8×10-10mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:填空题




查看答案和解析>>
科目: 来源: 题型:填空题
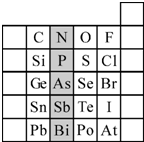


查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 两种气体A与B的相对分子质量之比为a:b | |
| B. | 同温同压下A、B两气体的密度之比为b:a | |
| C. | 同质量气体A与B的分子数之比为b:a | |
| D. | 相同状况下同体积A、B质量之比为a:b |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用托盘天平称量25.20g氯化钠固体 | |
| B. | 用湿润的红色布条检验HCl气体中 是否含有Cl2 | |
| C. | 用NaOH溶液和FeCl3溶液制备Fe(OH)3胶体 | |
| D. | 将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液 |
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钙 | B. | 磷 | C. | 铁 | D. | 碘 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com