
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 石墨、醋酸溶液、食盐晶体 | B. | 熔融状态的KOH、固态的NaCl | ||
| C. | 稀H2SO4、NaOH溶液、纯HNO3 | D. | 液氨、石灰水、水银 |
查看答案和解析>>
科目: 来源: 题型:解答题
 碳和氮是动植物体内的重要组成元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会造成光化学烟雾,目前,这些有毒有害气体的处理成为科学研究的重要内容.
碳和氮是动植物体内的重要组成元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会造成光化学烟雾,目前,这些有毒有害气体的处理成为科学研究的重要内容.| n/mol t/mol | NO | N2 | CO2 |
| 0 | 2.00 | 0 | 0 |
| 10 | 1.16 | 0.42 | 0.42 |
| 20 | 0.80 | 0.60 | 0.60 |
| 30 | 0.80 | 0.60 | 0.60 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 96倍 | B. | 48倍 | C. | 24倍 | D. | 12倍 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 浓硝酸在光照下颜色会变黄 | |
| B. | 在滴有酚酞的NaOH溶液中,加入HCl溶液后溶液的红色褪去 | |
| C. | FeSO4溶液在空气中久置后变黄色 | |
| D. | 向FeSO4溶液中滴加NaOH溶液,生成沉淀由白色变成灰绿色,最后变成红褐色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 过量澄清石灰水加入小苏打溶液:HCO${\;}_{3}^{-}$+OH-+Ca2+=CaCO3↓+H2O | |
| B. | 硫酸溶液中加入氢氧化钡溶液:H++SO${\;}_{4}^{2-}$+Ba2++OH-═BaSO4↓+H2O | |
| C. | 碳酸钙投入到盐酸:CO${\;}_{3}^{2-}$+2H+═CO2↑+H2O | |
| D. | 铁片加入到稀硫酸溶液中:Fe+2H+═Fe3++H2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 6g冰醋酸所含σ键数目为0.7NA | |
| B. | 1L 0.2mol/L的硫酸铝溶液中铝离子的物质的量为0.4NA | |
| C. | 6.72 LNO2和足量水完全反应,转移电子数是2NA | |
| D. | 标准状况下,11.2LN2和33.6LH2混合反应后可生成标况下的氨气22.4L |
查看答案和解析>>
科目: 来源: 题型:解答题
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g?cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
查看答案和解析>>
科目: 来源: 题型:解答题
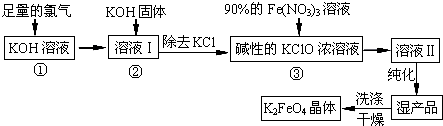
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com