
科目: 来源: 题型:选择题
| A. | Fe2+ | B. | I- | C. | Cl- | D. | Mn2+ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:选择题
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成甲、乙两份.向甲中逐渐加入铜粉,最多能溶解9.6g.向乙中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知:Fe+4HNO3(稀)=Fe(NO3)+NO↑+2H2O),下列分析结果不正确的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成甲、乙两份.向甲中逐渐加入铜粉,最多能溶解9.6g.向乙中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知:Fe+4HNO3(稀)=Fe(NO3)+NO↑+2H2O),下列分析结果不正确的是( )| A. | 原混合溶液中NO${\;}_{3}^{-}$的物质的量的浓度为4mol/L | |
| B. | AB段的反应为:Fe+2Fe3+=3Fe2+ | |
| C. | C点时,乙中溶质为FeSO4 | |
| D. | 标准状况下,OA,OB段产生的气体总体积约为4.48L |
查看答案和解析>>
科目: 来源: 题型:解答题
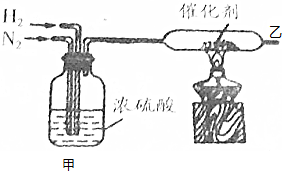
查看答案和解析>>
科目: 来源: 题型:选择题
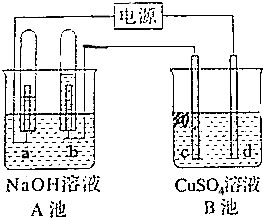 如图所示,A池用石墨电极电解pH=13的Na0H溶液100mL,B池为模拟电解精炼铜的装置,其中c电极为纯铜,d电极为粗铜(含有杂质Fe、Ag),溶液是足量CuSO4溶液,通电一段时间后停止电解,A池a极上产生的气体在标准状况下为2.24L,则下列说法正确的是( )
如图所示,A池用石墨电极电解pH=13的Na0H溶液100mL,B池为模拟电解精炼铜的装置,其中c电极为纯铜,d电极为粗铜(含有杂质Fe、Ag),溶液是足量CuSO4溶液,通电一段时间后停止电解,A池a极上产生的气体在标准状况下为2.24L,则下列说法正确的是( )| A. | d电极质量一定减少6.4g | B. | c电极质量一定增加6.4g | ||
| C. | A池pH不变 | D. | A池溶液质量减少3.6g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属钠投入水中Na+H2O═Na++OH-+H2↑ | |
| B. | NaOH溶液与过量的Ca(HCO3)2溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 在NaHSO4溶液中加入Ba(OH)2溶液到中性:Ba2++OH-+H++SO${\;}_{4}^{2-}$═-BaSO4↓+H2O | |
| D. | 小苏打溶液加入稀盐酸中:NaHCO3+H+═Na++H2O+CO2↑ |
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com