
科目: 来源: 题型:解答题
 CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g);△H=-867kJ•mol-1.该反应可用于消除氮氧化物的污染.在130℃和180℃时,分别将0.50molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g);△H=-867kJ•mol-1.该反应可用于消除氮氧化物的污染.在130℃和180℃时,分别将0.50molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:| 实验编号 | 温度 | 0 | 10 | 20 | 40 | 50 | |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | 0.15 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:多选题
| 反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
| 0 | 1.2 | 0.60 | 0 | 0 |
| t1 | 0.80 | |||
| t2 | 0.20 |
| A. | 0~t1 min内的平均反应速率v(H2)=$\frac{0.2}{{t}_{1}}$mol•L-1•min-1 | |
| B. | 平衡时CO的转化率为66.67% | |
| C. | t1时刻该反应处于平衡状态 | |
| D. | t2时刻CO的浓度为0.8 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
 据报道,在青藏高原冻土的一定深度下,发现了储量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4?nH2O).
据报道,在青藏高原冻土的一定深度下,发现了储量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4?nH2O).查看答案和解析>>
科目: 来源: 题型:解答题
 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题查看答案和解析>>
科目: 来源: 题型:解答题
 (1)氨在国民经济中占有重要地位.
(1)氨在国民经济中占有重要地位.
查看答案和解析>>
科目: 来源: 题型:解答题
| 时间 (s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol/L | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
查看答案和解析>>
科目: 来源: 题型:选择题
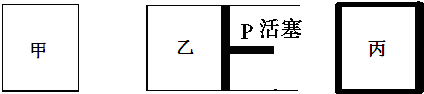
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 1 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
| A. | N2的转化率:丙是甲的二倍 | |
| B. | 三个容器内反应的平衡常数:甲=乙>丙 | |
| C. | 达平衡时氨气的体积分数:甲>乙>丙 | |
| D. | 放出热量关系:b<a<92.4 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 实验 序号 | t/min c/(mol•L-1) 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.50 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com