
科目: 来源: 题型:解答题
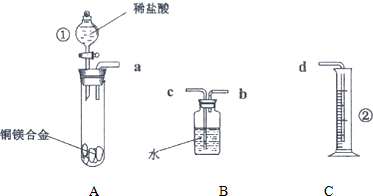
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 NO2和N2O4之间发生反应:2NO2?N2O4(g),一定温度下,体积为2L的密闭容器中,各物质的物质的量随时间变化的关系如图所示.回答下列问题
NO2和N2O4之间发生反应:2NO2?N2O4(g),一定温度下,体积为2L的密闭容器中,各物质的物质的量随时间变化的关系如图所示.回答下列问题查看答案和解析>>
科目: 来源: 题型:解答题
 某可逆反应进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的化学方程式为2A+B?2C;反应开始至2分钟,能用C表示反应速率吗?不能(填“能”或“不能”),原因不能确定溶液的体积,所以不能计算浓度的变化,无法计算反应速率.
某可逆反应进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的化学方程式为2A+B?2C;反应开始至2分钟,能用C表示反应速率吗?不能(填“能”或“不能”),原因不能确定溶液的体积,所以不能计算浓度的变化,无法计算反应速率.查看答案和解析>>
科目: 来源: 题型:解答题
 和田玉因产于新疆和田而得名,以透闪石玉中的精品扬名于天下.透闪石玉又叫软
和田玉因产于新疆和田而得名,以透闪石玉中的精品扬名于天下.透闪石玉又叫软查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 熔化状态下,能导电的物质一定是电解质 | |
| B. | 溶于水能导电的物质一定是电解质 | |
| C. | 熔化状态下,不能导电的化合物一定不是电解质 | |
| D. | BaSO4是强电解质 |
查看答案和解析>>
科目: 来源: 题型:解答题
 甲醇是新型的汽车动力燃料.工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO (g)+2H2(g)?CH3OH (g)△H1=-116kJ•mol-1
甲醇是新型的汽车动力燃料.工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO (g)+2H2(g)?CH3OH (g)△H1=-116kJ•mol-1查看答案和解析>>
科目: 来源: 题型:解答题
时间 浓度(mol?L-1) 温度 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com