
科目: 来源: 题型:选择题
| A. | 容量瓶内含少量水 | B. | 氢氧化钠中含有少量碳酸钠 | ||
| C. | 俯视定容 | D. | 溶解后立即定容 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 14.3g | B. | 21.2g | C. | 10.6g | D. | 12.9g |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铁跟盐酸的反应 Fe+2H+═Fe3++H2↑ | |
| B. | 铁片和CuSO4溶液的反应 2Fe+3Cu2+═3Cu+2Fe3+ | |
| C. | 钠与跟水反应 Na+H2O═Na++OH-+H2↑ | |
| D. | 氯化铁溶液和氢氧化钠溶液的反应Fe3++3OH-═Fe(OH)3↓ |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 CO可用于合成甲醇.在压强为0.1MPa条件下,在体积 为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:
CO可用于合成甲醇.在压强为0.1MPa条件下,在体积 为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:查看答案和解析>>
科目: 来源: 题型:解答题
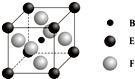 A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题:
A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=l的溶液中:Fe2+、Na+、S042-、N03- | |
| B. | 水电离的c(H+)=l×l0-13mol/L的溶液中:NH4+、K+、Cl-、HC03- | |
| C. | KMn04溶液中:H+、Na+、S042-、C2H50H | |
| D. | 使甲基橙变红色的溶液中:NH4+、Al3+、N03-、Cl- |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com