
科目: 来源: 题型:选择题
| A. | 8个中子的碳原子:12C | B. | HClO的结构式:H-Cl-O | ||
| C. | 镁离子的结构示意图: | D. | 15N的电子排布式:1s22s22p4 |
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:填空题
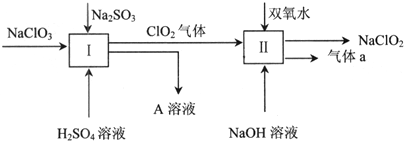
查看答案和解析>>
科目: 来源: 题型:填空题
| 化学方程式 | 焓变 △H/(kJ•mol-1) | 活化能 Ea/(kJ•mol-1) | |
| 甲烷氧化 | CH4(g)+2O2(g)═CO2(g)+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g)═CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸汽重整 | CH4(g)+H2O(g)═CO(g)+3H2(g) | +206.2 | 240.1 |
| CH4(g)+2H2O(g)═CO2(g)+4H2(g) | +165.0 | 243.9 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1mo/L | B. | 0.15mol/L | C. | 0.2mol/L | D. | 0.3mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4LCCl4中含CCl4分子数为NA | |
| B. | 4.0gNaOH固体溶于100 mL水中,得到1 mol/L的NaOH溶液 | |
| C. | 常温常压,5.6gFe在足量Cl2中燃烧,转移的电子数为0.3NA | |
| D. | 分子总数为NA的SO2和CO2的混合气体中含有的氧原子数为4NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下可用铁制容器盛装浓硝酸 | B. | 氧化铁常用作红色油漆和涂料 | ||
| C. | 硅胶常用作食品、药品干燥剂 | D. | 生石灰可用作食品的抗氧化剂 |
查看答案和解析>>
科目: 来源: 题型:解答题
 50mL 0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算反应热.请回答下列问题:
50mL 0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算反应热.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:填空题
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 |
| 达到平衡的时间(min) | t | 5 |
| 平衡时N2的浓度(mol•L-1) | 3 | c |
查看答案和解析>>
科目: 来源: 题型:解答题
 合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.
合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com