
科目: 来源: 题型:解答题
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体加入足量稀盐酸(或稀硫酸)溶解, 在溶液中滴加KSCN溶液 | 若溶液不变红色,则假设一成立. 若溶液变红色,则假设一不成立 |

查看答案和解析>>
科目: 来源: 题型:解答题
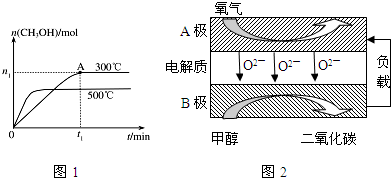
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
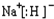 ;CA与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
;CA与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.查看答案和解析>>
科目: 来源: 题型:选择题
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A. | ① | B. | ②④ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | a=4 | B. | 还原剂是Fe2+ | ||
| C. | 氧化剂是O2 | D. | Y的化学式为Fe3O4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 过量CO2通入偏铝酸钠溶液中:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O═HClO+HSO${\;}_{3}^{-}$ | |
| C. | 酸性条件下双氧水和KI溶液反应:2I-+H2O2+2H+═I2+2H2O | |
| D. | 碳酸氢铵溶液与足量的KOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  实验室中制取少量的乙酸乙酯 | |
| B. |  比较硫、碳、硅三种元素的非金属性强弱 | |
| C. |  处理尾气 | |
| D. | 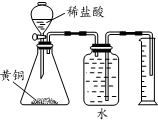 测定黄铜(Cu、Zn合金)中Zn 的含量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | - | Cl- | |
| ② | KClO3 | 浓盐酸 | - | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 表中②组反应的还原产物是KCl,电子转移数目是6e- | |
| B. | 氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2 | |
| C. | 表中①组的反应可能有一种或两种元素被氧化 | |
| D. | 表中③组反应的离子方程式为:2MnO${\;}_{4}^{-}$+3H2O2+6H+═2Mn2++4O2↑+6H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=1的溶液:Cu2+、Na+、NO3-、SO42- | |
| B. | 滴加紫色石蕊试液显红色的溶液:Fe2+、NH4+、Cl-、NO3- | |
| C. | 水电离出来的c(H+)=10-12mol/L的溶液:K+、Mg2+、SiO32-、Br- | |
| D. | 滴入KSCN显血红色的溶液中:Na+、Ba2+、Cl-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com