
科目: 来源: 题型:选择题
| A. | 20 mL 10 mol•L-1的浓硝酸与足量铜加热反应转移电子数为0.2NA | |
| B. | 标准状况下,11.2L氦气中含有NA原子 | |
| C. | 在精炼铜或电镀铜的过程中,当阳极消耗铜32g时,转移电子数均为NA | |
| D. | 标准状况下,2.24L Cl2通入足量NaOH溶液中发生反应转移的电子数为0.1NA |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯水中:C (Cl2)=2[C (ClO-)+C (Cl-)+C (HClO)] | |
| B. | 氯水中:c(C l-)>C (H+)>C (OH-)>C (ClO-) | |
| C. | 等体积等浓度的氢氧化钠与醋酸混合:C (Na+)=C (CH3COO-) | |
| D. | Na2CO3溶液中:C (Na+)>C (CO${\;}_{3}^{2-}$)>C (OH-)>C (HCO${\;}_{3}^{-}$)>C (H+) |
查看答案和解析>>
科目: 来源: 题型:填空题


查看答案和解析>>
科目: 来源: 题型:填空题
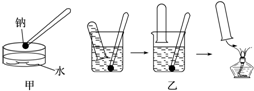 金属钠与水的反应是中学化学中的一个重要反应.该反应的演示方法分别如图甲、乙所示:
金属钠与水的反应是中学化学中的一个重要反应.该反应的演示方法分别如图甲、乙所示:查看答案和解析>>
科目: 来源: 题型:填空题


| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | 612 | 436 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应过程中MnO2作催化剂 | B. | 盐酸未反应完 | ||
| C. | 被还原的HCl少于0.2mol | D. | 反应产生2.24L氯气(标准状况) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1.8 g重水(D2O)中含有的质子数和中子数均为NA | |
| B. | 将11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5 NA | |
| C. | 100 mL 12 mol•L-1的浓HNO3与过量Cu反应转移电子的数目为0.6 NA | |
| D. | 标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2 NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 过氧化钙(CaO2)的电子式: | |
| B. | ${\;}_8^{16}{O^{2-}}$离子的结构示意图: | |
| C. | 质子数为94、中子数为144的钚(Pu)原子:${\;}_{94}^{144}$Pu | |
| D. | 葡萄糖的结构简式:C6H12O6 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com