
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
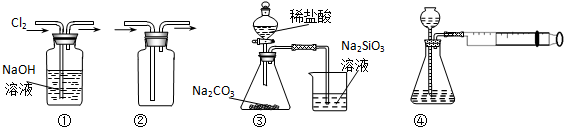
| A. | 装置①可用于除去Cl2中含有的少量HCl气体 | |
| B. | 装置④向左推动针筒活塞可检验该装置的气密性 | |
| C. | 装置③可证明非金属性Cl>C>Si | |
| D. | 按装置②所示的气流方向可用于收集H2、NH3等 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 苯酚钠溶液中通入少量二氧化碳气体: | |
| B. | 金属铝溶于NaOH溶液:Al+2OH-=AlO2-+H2↑ | |
| C. | 澄清石灰水与过量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| D. | NaHCO3的水解:HCO3-+H2O?H3O++CO32- |
查看答案和解析>>
科目: 来源: 题型:填空题
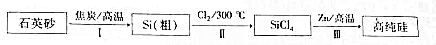
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将该气体通入澄清石灰水中变浑浊,则一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则一定有SO42- | |
| C. | 加入稀硝酸无明显现象,再加入硝酸银有白色沉淀产生,则一定有Cl- | |
| D. | 加入Na2CO3 溶液产生白色沉淀,再加盐酸,白色沉淀消失,则一定有Ba2+ |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
 为了测量NaHCO3和Na2CO3混合物中Na2CO3的质量分数,有人设计了如下的装置.准确称取混合物样品m g盛于试管B中并连接装置,其中C、D为玻璃管,C带有刻度,回答下面有关小题.
为了测量NaHCO3和Na2CO3混合物中Na2CO3的质量分数,有人设计了如下的装置.准确称取混合物样品m g盛于试管B中并连接装置,其中C、D为玻璃管,C带有刻度,回答下面有关小题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com