
科目: 来源: 题型:解答题
 如图所示装置:
如图所示装置:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在25℃纯水中,c(H+)=c(OH-)=10-7 mol/L,呈中性 | |
| B. | 溶液中,若c(H+)>10-7mol/L,则c(H+)>c(OH-),呈酸性 | |
| C. | c(H+)越大,则pH 越大,溶液的碱性越强 | |
| D. | pH为0的溶液,其中只有H+而无OH- |
查看答案和解析>>
科目: 来源: 题型:选择题
 常温下,将足量的CO2慢慢通入一定体积某浓度的NaOH溶液中,溶液的pH随CO2体积(已换算成标准状况)的变化曲线如图所示(不考虑过量的CO2在水中的溶解和反应过程中溶液体积的变化),则下列说法中不正确的是( )
常温下,将足量的CO2慢慢通入一定体积某浓度的NaOH溶液中,溶液的pH随CO2体积(已换算成标准状况)的变化曲线如图所示(不考虑过量的CO2在水中的溶解和反应过程中溶液体积的变化),则下列说法中不正确的是( )| A. | NaOH溶液的物质的量浓度为0.1mol/L | |
| B. | NaOH溶液的体积为2L | |
| C. | 当通入3.36LCO2时溶液中粒子浓度的大小关系满足c(CO32-)>c(HCO3-) | |
| D. | M、N点对应的纵坐标均大于7 |
查看答案和解析>>
科目: 来源: 题型:解答题
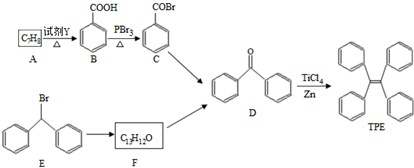
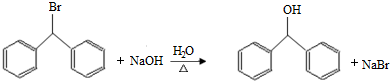 .
.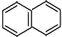 )的一元取代物;
)的一元取代物;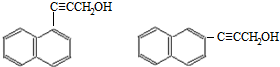 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小.请回答下列问题:
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 为比较Cl与S元素的非金属性强弱,相同条件下,测定相同浓度的NaCl溶液和Na2S溶液的pH值 | |
| B. | 为观察Mg条在CO2气体中的燃烧,在一个底部铺有少量玻璃棉的集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶底部 | |
| C. | 为验证盐桥的作用,在两个烧杯中分别盛适量硫酸亚铁铵和稀酸性高锰酸钾溶液,分别插入石墨棒用导线与电流计相连,然后用装有K2SO4饱和溶液的琼脂的U型管两端插入两个烧杯中,电流计偏转,一段时间后高锰酸钾溶液褪色 | |
| D. | 为测定一定浓度的NaOH溶液放置空气中是否部分转化为Na2CO3,用甲基橙作指示剂用标准盐酸溶液滴定 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | H+H→H-H | |
| B. | Mg+2HCl═MgCl2+H2↑ | |
| C. | 2Al+Fe2O3=Al2O3+2Fe | |
| D. | 2NH4Cl+Ba(OH)2•8H2O═BaCl2+2NH3↑+10H2O |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该反应中的还原剂是S2O32- | |
| B. | H2O参与该反应,且作氧化剂 | |
| C. | 上述反应中,每生成1 mol SO42-,可脱去2 mol Cl2 | |
| D. | 根据该反应可判断氧化性:Cl2>SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com