
科目: 来源: 题型:选择题
| A. | N2既是氧化剂又是还原剂 | |
| B. | NaN3中N元素被还原 | |
| C. | 每生成16molN2转移30mole- | |
| D. | 还原产物与氧化产物质量之比为1:15 |
查看答案和解析>>
科目: 来源: 题型:解答题
 现有常温下的六份溶液:
现有常温下的六份溶液:查看答案和解析>>
科目: 来源: 题型:解答题
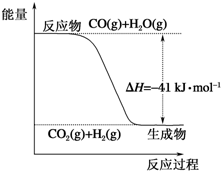 (1)根据图示写出热化学方程式:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1.
(1)根据图示写出热化学方程式:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=7的溶液一定是中性 | |
| B. | 若某盐溶液呈酸性或碱性,一定是由于该盐发生了水解反应 | |
| C. | c(H+)<c(OH-)的溶液一定呈碱性 | |
| D. | 在100℃时,纯水的pH<7,因此显酸性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 叙述Ⅰ | 叙述Ⅱ | |
| A | NaHCO3能与碱反应 | 食品工业用NaHCO3作焙制糕点的膨松剂 |
| B | Al既可和酸反应又可和强碱反应 | Al可制成铝箔包装物品 |
| C | 浓硫酸有吸水性 | 浓硫酸可干燥CO、SO3、H2S |
| D | K2FeO4能与水作用生成Fe(OH)3胶体和O2 | 可K2FeO4用于净化自来水并杀菌消毒 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氧化性:A2+>B2+>C2+>D2+ | B. | 氧化性:D2+>C2+>B2+>A2+ | ||
| C. | 还原性:A>B>C>D | D. | 还原性:D>B>A>C |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原 | |
| B. | 得电子越多的氧化剂,其氧化性就越强 | |
| C. | 阳离子只有氧化性,阴离子只有还原性 | |
| D. | 有单质参加的反应不一定属于氧化还原反应 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com