
科目: 来源: 题型:选择题
 反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1<p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1<p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )| A. | 上述反应是放热反应 | B. | 上述反应是吸热反应 | ||
| C. | a>b | D. | a=b |
查看答案和解析>>
科目: 来源: 题型:解答题
 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4次氯酸的强氧化性能杀死水中的病菌.但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4次氯酸的强氧化性能杀死水中的病菌.但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:查看答案和解析>>
科目: 来源: 题型:解答题
 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lgc(M),pc(CO32-)=-lgc(CO32-).下列说法正确的是BD.
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lgc(M),pc(CO32-)=-lgc(CO32-).下列说法正确的是BD.查看答案和解析>>
科目: 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3.0×10-8 |
| K2 | -- | 5.6×10-11 | -- |
查看答案和解析>>
科目: 来源: 题型:解答题


 (苯胺,易被氧化)
(苯胺,易被氧化)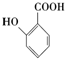 的名称为邻羟基苯甲酸;
的名称为邻羟基苯甲酸; ;
; ;
; 的合成路线.(无机试剂任用)
的合成路线.(无机试剂任用)查看答案和解析>>
科目: 来源: 题型:解答题
 过氧化氢是用途很广的绿色氧化剂,它的水溶液俗称双氧水,常用于消毒、杀菌、漂白等.试回答下列问题:
过氧化氢是用途很广的绿色氧化剂,它的水溶液俗称双氧水,常用于消毒、杀菌、漂白等.试回答下列问题: .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用湿润的pH试纸测定稀酸的pH,测定值偏大 | |
| B. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小 | |
| C. | 中和滴定前滴定管尖嘴处有气泡,终点读数时无气泡,所测溶液体积偏大 | |
| D. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在燃煤时加入石灰石,可减少SO2的排放:2CaCO3+O2+2SO2═2CaSO4+2CO2 | |
| B. | 用食醋除去暖水瓶中的水垢:2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O | |
| C. | 在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4,可降低土壤的碱性:CaSO4+Na2CO3═CaCO3+Na2SO4 | |
| D. | 自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶的PbS,慢慢转变为铜蓝(CuS):Cu2++PbS═CuS+Pb2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com