
科目: 来源: 题型:解答题

| 温度/℃ 溶解度/g | 10 | 20 | 30 | 40 | 60 |
| KC2O3 | 107 | 109 | 111 | 114 | 126 |
| KMnO4 | 2.83 | 4.31 | 6.34 | 9.03 | 12.6 |

查看答案和解析>>
科目: 来源: 题型:解答题
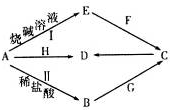
 ,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.| O=O(g) | H-H(g) | H-O(g) | |
| 键能/kJ•mol-1 | 496 | x | 463 |
查看答案和解析>>
科目: 来源: 题型:选择题

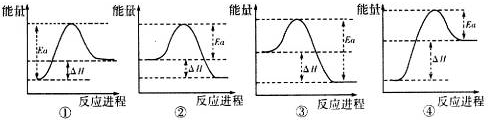
| A. | 图①表示向乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 | |
| B. | 图②表示向1 L l mol•L-1.FeBr2溶液中通入Cl2时Br-物质的量的变化 | |
| C. | 图③表示向Ca(HCO3)2溶液中滴加NaOH溶液时沉淀质量的变化 | |
| D. | 图④表示向一定浓度的Na2CO3溶液中滴加盐酸,生成CO2的物质的量与滴加盐酸物质的量的关系 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | LiH和D2O反应,所得氢气的摩尔质量为4 g•mol-1 | |
| B. | 1 mol LiAlH4在125℃完全分解转移3 mol电子 | |
| C. | LiH与水反应的化学方程式为LiH+H2O═LiOH+H2↑ | |
| D. | LiH中微粒半径r(Li+)<r(H-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,18 g H2O中含有的质子数为10 NA | |
| B. | 标准状况下,2.24 L C12通入水中,反应转移的电子数为0.1 NA | |
| C. | 常温常压下,53.5 g NH4Cl晶体中含有共价键的数目为4 NA | |
| D. | 常温常压下,2 L 0.5 mol•L-1硫酸钾溶液中阴、阳离子总数大于3 NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:A13++4NH3•H2O═4NH4++2H2O+A1O2- | |
| B. | 氯化亚铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| C. | NaHCO3溶液和过量的Ba(OH)2溶液混合:2HCO3-+OH-+Ba2+═BaCO3↓+2H2O+CO32- | |
| D. | 用氨水吸收少量二氧化硫:2NH3•H2O+SO2═2NH4++SO32-+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:W<X<Y<Z | |
| B. | X、Y、Z单质的熔点:Z<Y<X | |
| C. | 简单气态氢化物的热稳定性:Y<Z<W | |
| D. | Z元素的最高价氧化物对应水化物的分子中存在非极性共价键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cu与过量的S混合加热,最终得到CuS | |
| B. | 将氯气通入冷的消石灰中制漂白粉 | |
| C. | 常温下,将27 g A1投入足量18.4 mol•L-1的硫酸中,产生1.5 mol H2 | |
| D. | 将SO2不断通入Ba(OH)2溶液中,最终得到白色沉淀 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 编号 | 实验操作 | 目的 |
| A | 取4gNaOH固体溶入100mL水中 | 配制4mol•L-1NaOH溶液 |
| B | 向沸水中逐滴加入1~2mLFeCl3饱和溶液,搅拌并继续煮沸出现浑浊 | 制备Fe(OH)3胶体 |
| C | 测定等物质的量浓度的盐酸、硝酸的pH | 比较Cl、N的非金属性强弱 |
| D | 用熔融氧化铝、CCl4做导电性实验 | 验证两者是离子化合物还是共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | SiO2是酸性氧化物,能与NaOH溶液反应生成盐和水 | |
| C. | O3和O2为同种元素组成的单质,所以O3和O2互为同位素 | |
| D. | Na2O和Na2O2组成元素相同,与H2O的反应产物也相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com