
科目: 来源: 题型:解答题
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
查看答案和解析>>
科目: 来源: 题型:解答题
 在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 任何浓度的溶液都可以用pH来表示其酸性的强弱 | |
| B. | c(H+)=1×10-7 mol•L-1的溶液一定是中性溶液 | |
| C. | 0.2 mol•L-1 CH3COOH溶液中的c(H+)是0.1 mol•L-1 CH3COOH溶液中的c(H+)的2倍 | |
| D. | 无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)•c(OH-)都是定值 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 熔融状态下的NaHSO4电离:NaHSO4═Na++H++SO${\;}_{4}^{2-}$ | |
| B. | Fe(OH)3的电离:Fe(OH)3?Fe3++3OH- | |
| C. | H2CO3的电离:H2CO3?2H++CO${\;}_{3}^{2-}$ | |
| D. | 水溶液中的NaHSO4电离:NaHSO4═Na++HSO${\;}_{4}^{-}$ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
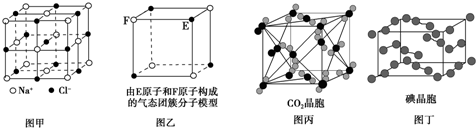
| A. | 在NaCl晶体(图甲)中,距Na+最近的Cl-形成正八面体 | |
| B. | 该气态团簇分子(图乙)的分子式为E4F4或F4E4 | |
| C. | 在CO2晶体(图丙)中,一个CO2分子周围有12个CO2分子紧邻 | |
| D. | 在碘晶体(图丁)中,碘分子的排列只有一种方向 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑤ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 非金属元素组成的化合物中只含共价键 | |
| B. | 水溶液能导电的化合物一定是离子化合物 | |
| C. | 化合物MgO、SiO2、SO3中化学键的类型相同 | |
| D. | PH3分子稳定性低于NH3分子,因为N-H键键能高 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com