
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| B. | Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O${\;}_{4}^{-}$)+2c(H2C2O4) | |
| C. | Na2CO3溶液:c(Na+)+c(H+)=2c(CO${\;}_{3}^{2-}$)+c(OH-) | |
| D. | CH3COONa溶液:c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
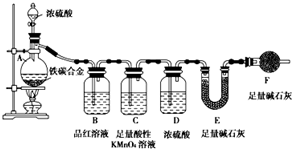 现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如下实验方案和实验装置
现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如下实验方案和实验装置查看答案和解析>>
科目: 来源: 题型:多选题
| A. | NaCl固体与无水乙醇混合无法形成胶体分散系 | |
| B. | 明矾常用作净水剂,是因为它具有消毒杀菌的作用 | |
| C. | 氨常用作制冷剂,是因为其沸点极低,很容易液化 | |
| D. | SiCl4在战争中常用作烟雾弹,是因为它与水反应时生成白色烟雾 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①中的I2为固态,②中的I2为气态 | B. | 254 g I2(g)完全反应放热9.48 kJ | ||
| C. | ①的产物比②的产物热稳定性更好 | D. | 1 mol固态碘升华时将吸热17 kJ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④⑦ | B. | ②③ | C. | ③⑤ | D. | ②⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | MgO Al | B. | CO2 Mg | C. | Fe2O3 Al | D. | CuO H2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径的大小顺序r(X)>r(Y)>r(Z)>r(R)>r(W) | |
| B. | 氢气在R的单质中燃烧火焰呈蓝色 | |
| C. | 元素X的氢化物的稳定性比Y的弱 | |
| D. | Y与Z形成的两种化合物中的化学键类型均相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 减少CO2的排放,可以减少酸雨的产生 | |
| B. | 为减少SO2的排放,可在燃煤中加入石灰石,这样可以从根本上消除雾霾 | |
| C. | “天宫一号”使用的碳纤维,是一种新型有机高分子材料 | |
| D. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com