
科目: 来源: 题型:多选题
 一定条件下存在反应C(s)+H2O(g)═CO(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示.下列说法正确的是( )
一定条件下存在反应C(s)+H2O(g)═CO(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示.下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | V |
| 温度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2molC 1molH2O | 1molCO 1molH2 | 4molC 2molH2O |
| A. | 甲容器中,反应在前15min的平均速率v(H2)=0.1 mol•L-1•min-1 | |
| B. | 丙容器的体积V>0.5L | |
| C. | 当温度为T1℃时,反应的平衡常数K=4.5 | |
| D. | 乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 为了防止食品受潮及富脂食品氧化变质,常在包装袋中放入硅胶和硫酸亚铁( ) | |
| B. | 积极推行和使用能被微生物降解的新型聚合物材料 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 废旧电池应集中回收,不能填埋处理 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯气与水反应:Cl2+H2O═Cl-+2H++ClO- | |
| B. | 氨气通入醋酸溶液中:NH3+H+═NH4+ | |
| C. | 制备Fe(OH)3胶体:Fe3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3(胶体)+3H+ | |
| D. | 碳酸氢钠溶液中加入过量石灰水:HCO3-+OH-═CO32-+H2O |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5 min内D的平均反应速率为0.02 mol•L-1•min-1 | |
| B. | 5 min内A的平均反应速率为0.06 mol•L-1•min-1 | |
| C. | 经5 min后,向容器内再加入C,正反应速率变小 | |
| D. | 平衡状态时,生成1 mol D时同时生成1 mol A |
查看答案和解析>>
科目: 来源: 题型:解答题
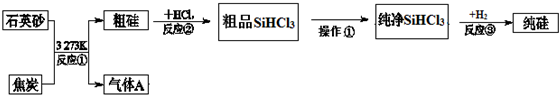
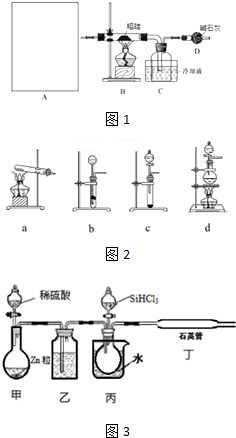
| 物质 | SiCl4 | SiHCl3 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | 33.0 | - | 315 |
| 升华温度/℃ | - | - | 180 | 300 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com