
科目: 来源: 题型:选择题
| A. | 在Cl2中点燃铁丝,有FeCl2生成 | |
| B. | 实验室利用废铜屑制取CuSO4溶液的最好的方法是将铜屑在空气中灼烧后再溶于稀H2SO4 | |
| C. | 小苏打的主要成分是碳酸钠 | |
| D. | 实验室用氯化铵溶液和氢氧化钙溶液混合制取氨气 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NO是无色气体 | |
| B. | NO气体难溶于水 | |
| C. | 打开盛NO气体的瓶盖,立即看到瓶口有红棕色气体生成 | |
| D. | NO是无毒气体 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

| X | Y | Z | |
| 第一电离能(KJ/mol) | 526.2 | 502.8 | 425.2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol乙基(-C2H5)中含有的电子数为16NA | |
| B. | 8g CH4中含有10NA个电子 | |
| C. | 标准状况下22.4L氯仿(三氯甲烷)中共价键数目为4NA | |
| D. | 28g乙烯、丙烯、丁烯的混合气体,其碳原子数为2NA |
查看答案和解析>>
科目: 来源: 题型:解答题
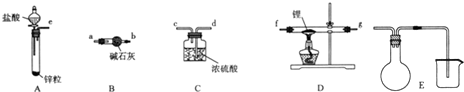
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 无色溶液中:K+、Na+、Cu2+、SO42- | |
| B. | c(OH-)=10-13 mol•L-1的溶液中:Al3+、NO3-、I-、Cl- | |
| C. | 水电离产生的c(H+)=10-13 mol•L-1的溶液中:Na+、Cl-、NO3-、SO42- | |
| D. | 0.1 mol•L-1FeSO4溶液中:K+、NH4+、MnO4-、ClO- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 我国以三个强度等级(42.5、52.5、62.5)表示水泥的性能,等级越高性能越好 | |
| B. | 光导纤维的主要成分是石英玻璃 | |
| C. | 新型陶瓷分成两大类,即结构陶瓷(如纳米陶瓷)和功能陶瓷(如生物陶瓷) | |
| D. | 在玻璃中加入金属氧化物,可以使玻璃呈现颜色,例如加入氧化亚铜(Cu2O)呈蓝色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com