
科目: 来源: 题型:选择题

| A. | ab | B. | bc | C. | cd | D. | bd |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 紧闭门窗,防止装修面干裂或变质 | |
| B. | 适度开窗通风,充分进行室内外空气对流 | |
| C. | 请专业环境监测人员进行检测 | |
| D. | 在各个房间均匀地适量放置吊兰、芦荟等 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①⑤⑥ | B. | ②④⑥ | C. | ⑤⑥ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
 下列实验操作正确的是( )
下列实验操作正确的是( )| A. | 可用磨口玻璃瓶保存NaOH溶液 | |
| B. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 | |
| C. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| D. | 用装置乙加热分解NaHCO3固体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4 LCCl4含有NA个CCl4分子 | |
| B. | 27g铝被完全氧化成氧化铝,失去2NA个电子 | |
| C. | 在标准状况下,1molNH3和CO混合气体所占的体积约为22.4L | |
| D. | 常温常压下,28g乙烯含有2NA个碳碳双键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 自来水可用氯气来杀菌消毒,说明氯气无毒 | |
| B. | 福尔马林可作食品的保鲜剂 | |
| C. | 目前我市的汽油标准己由“国III”提到“国Ⅳ”,这意味着汽车不再排放氮氧化物 | |
| D. | 推广使用可降解塑料及布质购物袋,以减少“白色污染” |
查看答案和解析>>
科目: 来源: 题型:解答题
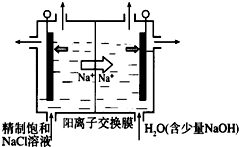 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com