
科目: 来源: 题型:解答题
| 元素 | 原子半径 | 电负性 | 第一电离能 |
| C | 67pm | 2.55 | 1125.8kJ/mol |
| S | 88pm | 2.58 | 1036.7kJ/mol |
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH3-CH2-CH3 | B. | (CH3)2CHCl | C. | (CH3)2CHOH | D. | (CH3)2CHBr |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该溶液的pH一定是9 | B. | 该溶液的溶质可能是可水解的盐 | ||
| C. | 该溶液的溶质可能是酸或碱 | D. | 不可能有这样的溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢氧燃料电池在碱性介质中负极的反应式是:O2+2H2O+4e-═4OH- | |
| B. | NaHCO3在水溶液中的水解离子方程式:HCO${\;}_{3}^{-}$+H2O═CO2↑+OH- | |
| C. | 用FeS为沉淀剂除去废水中的Hg2+:FeS(s)+Hg2+(aq)═HgS(s)+Fe2+(aq) | |
| D. | 将Na2CO3在水溶液加热蒸干,由于CO2易挥发,最终得到NaOH固体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢能可再生,没有污染,现已用作火箭和燃料电池的燃料 | |
| B. | 在环保领域,酸性或碱性废水的处理常常利用中和反应 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 | |
| D. | 工业生产中,使用催化剂能加快化学反应速率,提高反应物的转化率 |
查看答案和解析>>
科目: 来源: 题型:解答题
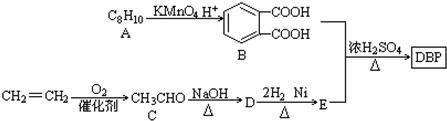
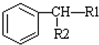 $\stackrel{KMnO_{2}H+}{→}$
$\stackrel{KMnO_{2}H+}{→}$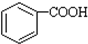
 (-R1、-R2表示氢原子或烃基)
(-R1、-R2表示氢原子或烃基)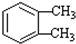 ,D→E的反应类型加成(或还原)反应.
,D→E的反应类型加成(或还原)反应.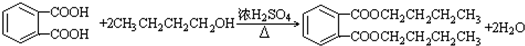 .
.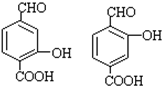 .
.查看答案和解析>>
科目: 来源: 题型:解答题


 .
. .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com