
科目: 来源: 题型:填空题
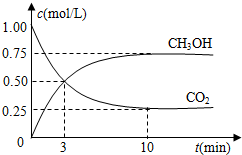
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 苯酚沾在手上,立即用氢氧化钠溶液洗涤 | |
| B. | 金属钠失火,立即用泡沫灭火器灭火 | |
| C. | 酒精灯失火后,立即用水扑灭 | |
| D. | 不慎将烧碱溶液溅到皮肤上,立即用水冲洗 |
查看答案和解析>>
科目: 来源: 题型:填空题
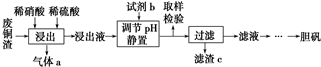
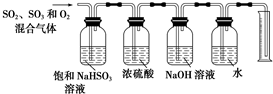
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ | |
| B. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U互为同位素 | |
| C. | H3O+和NH4+具有的电子数相同 | |
| D. | 用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| B. | 制取二氧化氮时,用水或NaOH溶液吸收尾气 | |
| C. | 为测定Na2CO3和NaHCO3混合物中Na2CO3质量分数,取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg,该方案可行 | |
| D. | 为测定镀锌铁皮的锌层厚度,将镀锌铁皮与足量盐酸反应待气泡明显减少时取出,洗涤,烘干,称重.若烘干时间过长,会导致测定结果偏小 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 电解过程中,a 电极表面先有红色物质析出,后有气泡产生 | |
| B. | b 电极上发生反应的方程式为:4OH--4e-=2H2O+O2↑ | |
| C. | 曲线 O~P 段表示 O2 的体积变化 | |
| D. | 从开始到 Q 点时收集到的混合气体的平均摩尔质量为 12 g/mol |
查看答案和解析>>
科目: 来源: 题型:多选题

| A. | 用甲图装置电解精炼铝 | |
| B. | 用乙图装置制备 Fe(OH)2 | |
| C. | 用丙图装置可制得金属锰 | |
| D. | 用丁图装置验证 NaHCO3 和 Na2CO3的热稳定性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 10 mL 20 mol•L-1 浓硫酸与足量锌反应,转移电子数为 0.2NA | |
| B. | 0.1 mol24Mg18O 晶体中所含中子总数为 2.0 NA | |
| C. | 在标准状况下,2.8g N2 和 2.24L CO 所含电子数均为 1.4NA | |
| D. | 1 L 1 mol•L-1 的 NaClO 溶液中含有 ClO-的数目为NA |
查看答案和解析>>
科目: 来源: 题型:解答题
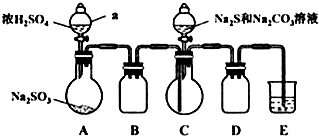
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com