
科目: 来源: 题型:选择题
| A. | 在上述两个反应中,水既不是氧化剂也不是还原剂 | |
| B. | 在上述两个反应中,氧化产物都是H3PO4 | |
| C. | 在反应(2)中,当有5mol CuSO4发生反应时,共转移10mol电子 | |
| D. | 在上述两个反应中,氧化剂都只有硫酸铜 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5微粒均具有丁达尔效应 | |
| C. | 漂白粉在空气中久置变质 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 | |
| D. | 浓硫酸可刻蚀石英制艺术品 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2A+2B?3C+D | B. | 3A+2B?2C+D | C. | 2A+B?3C+D | D. | 3A+B?2C+2D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用铁片和稀硫酸反应制氢气时,可改用98%的浓硫酸加快生成氢气速率 | |
| B. | 100 mL 2 mol•L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 | |
| C. | 汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 | |
| D. | SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢 |
查看答案和解析>>
科目: 来源: 题型:解答题
 用惰性电极电解200mL一定浓度的硫酸铜溶液,实验装置如图①所示,电解过程中的实验数据如图②所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).
用惰性电极电解200mL一定浓度的硫酸铜溶液,实验装置如图①所示,电解过程中的实验数据如图②所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).查看答案和解析>>
科目: 来源: 题型:选择题
| A. | P2VP和I2的复合物是绝缘体,不能导电 | |
| B. | 电池工作时,碘离子移向P2VP和I2的复合物 | |
| C. | 电池的总反应为2Li+P2VP•nI2═P2VP•(n-1)I2+2LiI | |
| D. | 若该电池所产生的电压较高,则该电池使用寿命比较长 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 纯铁的腐蚀属于电化学腐蚀 | |
| B. | 钢铁吸氧腐蚀时,负极的电极反应式为Fe-3e-═Fe3﹢ | |
| C. | 海轮在浸水部位镶一些铜锭可起到抗腐蚀作用 | |
| D. | 在图示氧浓差腐蚀中,M极处发生的电极反应为O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 一定条件下,0.2molSO2与足量O2充分反应,生成SO3分子数为0.2NA | |
| B. | 常温常压下,4.4gCO2与N2O混合气体中含有的原子总数为0.3NA | |
| C. | 标准状况下,2.24LCl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA | |
| D. | 标准状况下,22.4L甲苯中含C-H数目为8NA |
查看答案和解析>>
科目: 来源: 题型:解答题
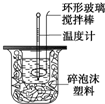 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温 度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4molA+2molB | B. | 3molB+1molD | ||
| C. | 2molA+1molB+3molC | D. | 1molA+0.5molB+1.5molC+0.6molD |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com