
科目: 来源: 题型:解答题
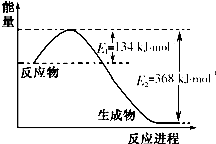 氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.| T/K | 398 | 498 |
| 平衡常数K | K1 | K2 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 在某一容积为5L的密闭容器内,加入0.2mol的CO和0.2mol的H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g).反应中CO2的浓度随时间变化情况如图:
在某一容积为5L的密闭容器内,加入0.2mol的CO和0.2mol的H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g).反应中CO2的浓度随时间变化情况如图:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 9:3:4 | B. | 3:1:2 | C. | 2:1:3 | D. | 3:2:1 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
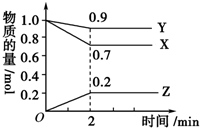 某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为Y+3X?2Z,反应开始至2min,X的转化率为30%.
某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为Y+3X?2Z,反应开始至2min,X的转化率为30%.查看答案和解析>>
科目: 来源: 题型:解答题
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |

查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 时间 | X | Y | Z | Q |
| 起始/mol | 0.7 | 1 | ||
| 2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末/mol | 0.8 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
 已知某温度下:
已知某温度下: (g)?
(g)? (g)+H2(g),△H=+117.6kJ/mol.
(g)+H2(g),△H=+117.6kJ/mol. (g)?
(g)? (g)+CO(g)+H2O(g)△H=+158.8 kJ/mol.该反应的化学平衡常数K=K1•K2(用K1、K2表示).
(g)+CO(g)+H2O(g)△H=+158.8 kJ/mol.该反应的化学平衡常数K=K1•K2(用K1、K2表示).| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com