
科目: 来源: 题型:填空题
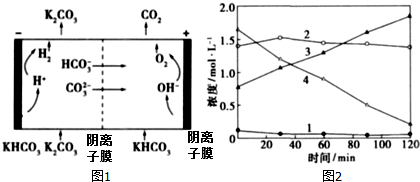
查看答案和解析>>
科目: 来源: 题型:填空题
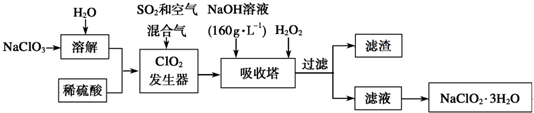
查看答案和解析>>
科目: 来源: 题型:填空题
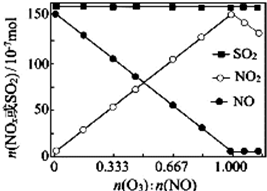 烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的化学方程式及室温下的平衡常数如下:
烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的化学方程式及室温下的平衡常数如下:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 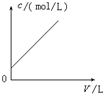 曲线可表示向0.1 mol/L CH3COONa溶液中加水稀释的过程中OH-浓度随溶液体积的变化趋势 | |
| B. | 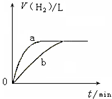 曲线a、b分别表示过量纯锌、过量粗锌(含Cu、C杂质)跟同浓度等体积盐酸反应过程中产生H2体积的变化趋势 | |
| C. | 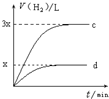 曲线c、d分别表示等质量的铝分别跟过量烧碱溶液、过量盐酸反应过程中产生H2体积的变化趋势 | |
| D. | 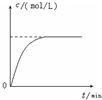 曲线可表示足量锌与一定量稀醋酸反应过程中,Zn2+浓度的变化趋势(假设反应过程中溶液体积保持不变) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯气能使干燥的有色布条褪色 | |
| B. | 能使湿润的淀粉KI 试纸变蓝的物质一定是氯气 | |
| C. | 电解饱和食盐水可制得氯气 | |
| D. | 氯原子和氯离子的化学性质相似,都具有强氧化性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铁分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | 一定条件下,铁粉与水蒸气可在高温下反应生成氢氧化铁 | |
| C. | Fe3+中的Fe2+可用KSCN溶液检验 | |
| D. | 稀硫酸不能和铜反应,但在上述混合物中加入Fe2O3 后铜能溶解 |
查看答案和解析>>
科目: 来源: 题型:解答题
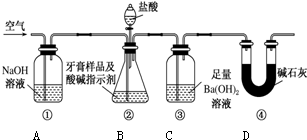
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1 mol CH4含有的电子数为NA | |
| B. | 1 L 1 mol/L的AlCl3溶液中含有NA个Al3+ | |
| C. | 7.8g过氧化钠所含阴离子数为0.2 NA | |
| D. | 标准状况下,22.4 L 己烷中共价键数为19NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | 向氯化铁溶液中加入NaOH溶液,可制得Fe(OH)3胶体 | |
| C. | 固体的NaCl不导电,熔融态的NaCl可以导电 | |
| D. | 在河流入海口处易形成三角洲原理与胶体的性质无关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com