
科目: 来源: 题型:选择题
 铅蓄电池的工作原理为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,研读如图,K闭合时下列判断不正确的是( )
铅蓄电池的工作原理为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,研读如图,K闭合时下列判断不正确的是( )| A. | d电极:PbSO4+2H2O-2e-=PbO2+4H++SO42- | |
| B. | 当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol | |
| C. | Ⅱ中SO42-向c电极迁移 | |
| D. | K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极 |
查看答案和解析>>
科目: 来源: 题型:选择题
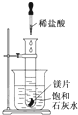 如图所示,把盛有几小块镁片的试管放入盛有25℃的饱和石灰水的烧杯中,再用滴管向试管中滴入2mL的稀盐酸.下列对烧杯中的实验现象的描述及原因说明中正确的是( )
如图所示,把盛有几小块镁片的试管放入盛有25℃的饱和石灰水的烧杯中,再用滴管向试管中滴入2mL的稀盐酸.下列对烧杯中的实验现象的描述及原因说明中正确的是( )| A. | 烧杯中出现白色浑浊,原因是试管中的反应放出热量使烧杯中饱 和石灰水温度升高,溶质析出 | |
| B. | 烧杯中出现白色浑浊,原因是试管中的反应吸收热量使烧杯中饱和石灰水温度降低,溶质析出 | |
| C. | 烧杯中没有任何现象,原因是试管中的反应与烧杯中饱和石灰水没有关系 | |
| D. | 烧杯中没有任何现象,原因是试管中的反应既不放出热量,也不吸收热量 |
查看答案和解析>>
科目: 来源: 题型:填空题
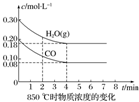 已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q,其平衡常数随温度变化如下表所示:
已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q,其平衡常数随温度变化如下表所示:| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原溶液中肯定不含Fe2+、NO3-、SiO32-、I- | |
| B. | 原溶液中肯定含有K+、Fe3+、Fe2+、NO3-、SO42- | |
| C. | 步骤Ⅱ中无色气体是NO气体,无CO2气体产生 | |
| D. | 为确定是否含有Cl-,可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Kw/c(H+)=1 mol•L-1的溶液中:Na+、SiO32-、I-、CO32- | |
| B. | 氨水中:Al3+、K+、F-、NO3- | |
| C. | pH=1的溶液中:NH4+、Na+、SO42-、CH3COO- | |
| D. | 0.1 mol•L-1的NaHSO4溶液中:K+、Fe2+、Cl-、NO3- |
查看答案和解析>>
科目: 来源: 题型:解答题
 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,且通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,且通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
 W、X、Y、Z分别为H、C、N、O元素
W、X、Y、Z分别为H、C、N、O元素查看答案和解析>>
科目: 来源: 题型:填空题
| 实验序号 | 实验步骤(内容) | 现象 |
| ① | 在贴有标签a、b的试管中分别加入1.0 g Na2CO3固体和NaHCO3固体,观察外观. | / |
| ② | 分别滴入几滴水,振荡,摸试管底部. | 试管 a吸热现象更明显(填“a”或“b”) |
| ③ | 继续向两试管中分别加入10.0 mL水,用力振荡,观察现象. | / |
| ④ | 再分别向两试管中滴加2滴酚酞溶液,观察现象. | 溶液均变红,颜色较深的试管是 a(填“a”或“b”). |
| ⑤ | 最后分别向两溶液中滴加足量盐酸. | 红色褪去,均有无色气体产生.经计算生成气体的是a <b(填“>”“<”或“=”) |
| ⑥ | 加热大试管一段时间.(注:棉花球沾有无水硫酸铜粉末) | / |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com