
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
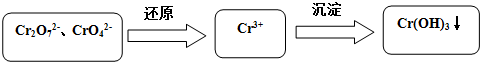
查看答案和解析>>
科目: 来源: 题型:解答题
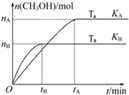 一定条件下,在容积为3L的密闭容器中加入1molCO和2molH2发生反应:CO(g)+2H2(g)?CH3OH(g)△H,达平衡状态.根据图示回答:
一定条件下,在容积为3L的密闭容器中加入1molCO和2molH2发生反应:CO(g)+2H2(g)?CH3OH(g)△H,达平衡状态.根据图示回答:查看答案和解析>>
科目: 来源: 题型:选择题
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
| A. | N2的转化率:②>①>③ | B. | 三个容器内反应的平衡常数:③>①>② | ||
| C. | 平衡时氨气的体积分数:①>③ | D. | 放出热量关系:2a<c<184.8 kJ |
查看答案和解析>>
科目: 来源: 题型:选择题
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
| A. | 达到平衡时,容器I中的CH3OH体积分数与容器Ⅱ相等 | |
| B. | 容器I中反应的平衡常数K=0.08 | |
| C. | 若起始时向容器I中充入CH3OH 0.1mol、CH3OCH30.15mol和H2O 0.10mol,则反应将向逆反应方向进行 | |
| D. | 容器I中反应达到平衡所需时间比容器Ⅲ中的长 |
查看答案和解析>>
科目: 来源: 题型:填空题
 将1molI2(g)和2molH2置于某2L密闭容器中,在一定温度下发生反应:
将1molI2(g)和2molH2置于某2L密闭容器中,在一定温度下发生反应:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{1}{4}$<$\frac{n(X)}{n(Y)}$<$\frac{3}{2}$ | B. | $\frac{1}{4}$<$\frac{n(X)}{n(Y)}$<$\frac{1}{2}$ | C. | $\frac{1}{4}$<$\frac{n(X)}{n(Y)}$<4 | D. | $\frac{1}{2}$<$\frac{n(X)}{n(Y)}$<4 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com