
科目: 来源: 题型:选择题
| A. | 阳极发生还原反应,其电极反应式:Ni2++2e-═Ni | |
| B. | 电解后,电解槽底部的阳极泥中只有Pt | |
| C. | 电解后,溶液中存在的阳离子只有Fe2+和Zn2+ | |
| D. | 电解过程中,阳极质量的减少与阴极质量的增加不相等 |
查看答案和解析>>
科目: 来源: 题型:选择题
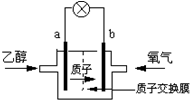 美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )
美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )| A. | a极为电池的负极 | |
| B. | 电池工作时电流由b极沿导线经灯泡再到a极 | |
| C. | 电池正极的电极反应为:2H++O2+4e-═H2O | |
| D. | 电池工作时1mol乙醇被氧化时就有6mol电子转移 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化学反应不一定伴随着能量的变化 | |
| B. | 氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=571.6kJ•mol-1 | |
| C. | 放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关D.所有燃烧反应都是放热反应,所以不需吸收能量就可以进行 | |
| D. | 所有燃烧反应都是放热反应,所以不需吸收能量就可以进行 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 实验室制备氢气 | |
| B. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 | |
| C. | 灼热的木炭与CO2的反应 | |
| D. | 铝粉与氧化铁粉末反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.
查看答案和解析>>
科目: 来源: 题型:解答题
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能(KJ/mol) | 356 | 413 | 336 | 226 | 318 | 452 |

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 第一电离能:Al>Mg | B. | 水溶性:CH3CH2OH>CH3CH2OCH2CH3 | ||
| C. | 沸点:HCl>HF | D. | 晶格能:NaCl>MgO |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2.3g钠与水反应失去的电子数目为0.2NA | |
| B. | 20℃、101Kpa时,5.6L氨气所含的原子数目为NA | |
| C. | 0℃、101Kpa时,18g铵根离子所含有的电子数为10NA | |
| D. | 1mol氯化钠固体溶于1L水所得的溶液中氯化钠的物质的量浓度为1mol/L |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com