
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1mol Zn,0.1mol Fe | B. | 1mol Fe,1mol Zn | ||
| C. | 1g Zn,1g Fe | D. | 10g Zn,10g Fe |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 两种气体质量相等 | B. | 两种气体的物质的量之比为16:1 | ||
| C. | 两种气体压强比为16:1 | D. | 两种气体体积比为1:16 |
查看答案和解析>>
科目: 来源: 题型:选择题
 如图的实验装置用来分离CO2和CO气体并干燥.图中a为止水夹,b为分液漏斗的活塞,通过Y 型管和止水夹分别接c.d 两球胆,现装置内的空气已排尽.为使实验成功,甲、乙、丙分别盛放的溶液是( )
如图的实验装置用来分离CO2和CO气体并干燥.图中a为止水夹,b为分液漏斗的活塞,通过Y 型管和止水夹分别接c.d 两球胆,现装置内的空气已排尽.为使实验成功,甲、乙、丙分别盛放的溶液是( )| A. | 饱和NaHCO3 溶液、12mol•L-1盐酸、18.4mol•L-1H2SO4 | |
| B. | 饱和Na2CO3 溶液、2mol•L-1 H2SO4、饱和NaOH 溶液 | |
| C. | 饱和NaOH 溶液、2mol•L-1 H2SO4、18.4mol•L-1H2SO4 | |
| D. | 18.4mol•L-1H2SO4、饱和NaOH 溶液、18.4mol•L-1H2SO4 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO32- | NO3- | Cl- |
| 浓度/mol•L-1 | 7×10-6 | 3×10-6 | 2×10-5 | 3×10-5 | 5×10-5 | 2×10-5 |


| 时间(min) 浓度(mol/L-1) | 0min | 10min | 20min | 30min | 40min | 50min |
| NO(mol/L-1) | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2(mol/L-1) | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2(mol/L-1) | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.02 | 20.00 | 24.98 |
| 实验序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 双氧水(mL) | 0.5 | 0.4 | 0.6 | 0.5 | |||
| pH | 11 | 11 | 11 | 10 | |||
| 反应时间 | 3 | 3 | 3 | 3 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
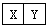 ,它们的单质都必须采用电解法制备,但都无需密封保存,
,它们的单质都必须采用电解法制备,但都无需密封保存,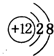 .(2)Y元素在周期表中位置第三周期ⅢA族.
.(2)Y元素在周期表中位置第三周期ⅢA族.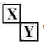 ,X、Y的最高价含氧酸的浓溶液都有强氧化性.
,X、Y的最高价含氧酸的浓溶液都有强氧化性.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com