
科目: 来源: 题型:选择题
| A. | 科学仪器的使用利于我们认识物质的微观世界,现在人们借助扫描隧道显微镜,应用SMT技术可以“看”到越来越细微的结构,并实现对原子或分子的操纵 | |
| B. | 利用外接直流电源保护铁质建筑物,属于外加电流的阴极保护法 | |
| C. | 今年,来自德国、加拿大和我国复旦、清华大学的研究人员通过紧密合作,成功制备出了含+9铱元素的离子(IrOn+).在这种离子中,n=8 | |
| D. | 分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 所含离子 | NO${\;}_{3}^{-}$ | SO${\;}_{4}^{2-}$ | H+ | Na+ | Mn+ |
| 浓度(mol/L) | 3 | 1 | 2 | 1 | a |
| A. | Mg2+、1 | B. | Ba2+、0.5 | C. | Al3+、1.5 | D. | Fe2+、2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | FeCl2 | B. | KNO3 | C. | FeSO4 | D. | HCl |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 10Q | B. | 5Q~10Q | C. | 3Q | D. | 8Q |
查看答案和解析>>
科目: 来源: 题型:解答题
 氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
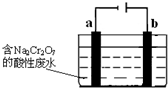 工业上可用电解法来处理含Cr2O72-的酸性废水,最终可将Cr2O72-转化成Cr(OH)3沉淀而被除去.如图为电解装置示意图(电极材料分别为铁和石墨):
工业上可用电解法来处理含Cr2O72-的酸性废水,最终可将Cr2O72-转化成Cr(OH)3沉淀而被除去.如图为电解装置示意图(电极材料分别为铁和石墨):查看答案和解析>>
科目: 来源: 题型:选择题
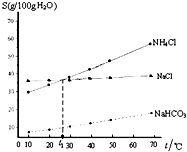
| A. | t1℃时,饱和NaCl和NH4Cl 溶液的物质的量浓度相同 | |
| B. | 相同温度下,NaHCO3在水中的溶解度比NaCl和NH4Cl小很多 | |
| C. | NH4Cl 溶解度随温度变化较大 | |
| D. | 工业上制纯碱可以向饱和的NaCl溶液中通入NH3和CO2,会有NaHCO3固体析出 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,3.0 g乙烷中含有的碳氢键数为0.6NA | |
| B. | 标准状况下,22.4 L C2H5OH中含有的氢原子数为6 NA | |
| C. | 常温常压下,92 g的 NO2和N2O4混合气体含有的分子数为 6 NA | |
| D. | 标准状况下,由Na2O2制得11.2 L O2,反应转移的电子数为0.5 NA |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com