
科目: 来源: 题型:解答题
| 滴定次数 | 待测液体积/mL | 标准碘溶液体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 平均值 | ||
| 1 | 25.00 | 0.00 | 14.97 | ① |
| 2 | 25.00 | 0.10 | 15.13 | |
| 3 | 25.00 | 0.22 | 14.93 | |
查看答案和解析>>
科目: 来源: 题型:解答题
 将0.1mol的镁、铝混合物溶于100mL,2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL,2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:查看答案和解析>>
科目: 来源: 题型:解答题
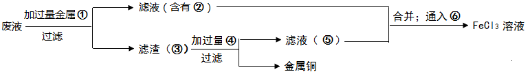
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 维生素C与“金施尔康”都是氧化剂 | |
| B. | 维生素C与“金施尔康”都是还原剂 | |
| C. | 维生素C是氧化剂,“金施尔康”是还原剂 | |
| D. | 维生素C是还原剂,“金施尔康”是氧化剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
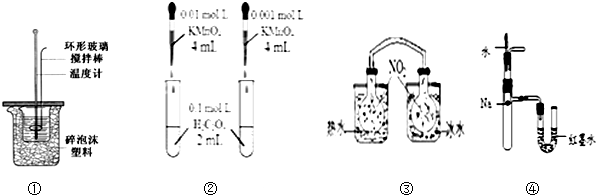
| A. | 装置①用于测定中和热装置 | |
| B. | 装置②依据褪色快慢比较浓度对反应速率的影响 | |
| C. | ③依据两容器内气体颜色变化,判断反应2NO2(g)?N2O4(g)平衡移动的方向 | |
| D. | 装置④依据U管两边液面的高低判断Na和水反应的热效应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| t/min | 2 | 4 | 6 | 8 | 10 |
| n(A)/mol | 0.16 | 0.13 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2 min的平均速率ν(C)=0.02 mol•L-1•min-1 | |
| B. | 平衡后降低温度,反应达到新平衡前ν(逆)>ν(正) | |
| C. | 其他条件不变,10 min后再充入一定量的A,平衡正向移动,A的转化率变小 | |
| D. | 保持其他条件不变,反应在恒压下进行,平衡时A的体积分数与恒容条件下反应相同 |
查看答案和解析>>
科目: 来源: 题型:解答题
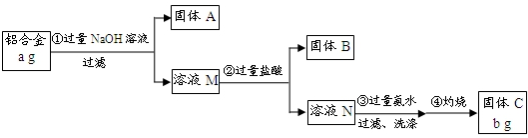
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碳酸钙与盐酸溶液反应:2H++CO32-=H2O+CO2 | |
| B. | 铁钉放入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 碳酸氢钠与稀盐酸反应:HCO3-+H+=CO2↑+H2O | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com