
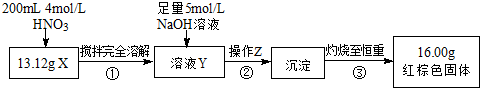
科目: 来源: 题型:解答题
| 编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有气泡产生 |
| ② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液出现血红色 |
| ③ | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少量红色物质析出,仍有较多黑色固体未溶解 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1L 1mol/LNaAlO2溶液中含有氧原子数为2NA | |
| B. | 标准状况下,33.6L三氧化硫中含有硫原子的数目为1.5NA | |
| C. | 1mol(-14CD3)中所含的中子数和电子数分别为11NA、9NA | |
| D. | 精练铜的过程中,当阳极溶解32g铜时转移的电子数为NA |
查看答案和解析>>
科目: 来源: 题型:解答题
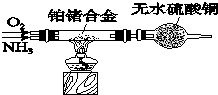 氮及其化合物在很多方面有重要的用途.
氮及其化合物在很多方面有重要的用途.查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  用锌粒和稀硫酸制H2 | B. |  用H2O2和MnO2制O2 | ||
| C. | 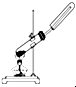 用氯化铵和氢氧化钙固体制NH3 | D. |  用铜片和稀硝酸制NO |
查看答案和解析>>
科目: 来源: 题型:解答题
| 分类标准 | 碱性氧化物 | 碱 | 含氧酸 | 盐 |
| 属于该类的物质 | ① | NaOH | ② | ③ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含氧化合物 | B. | 钠盐 | C. | 电解质 | D. | 碱性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com