
科目: 来源: 题型:选择题
| 二氧化碳 | 碳酸钠 | 转移的电子 | |
| A | 1mol | NA | |
| B | 22.4L | 1mol | |
| C | 212g | 1mol | |
| D | 106g | 2NA |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
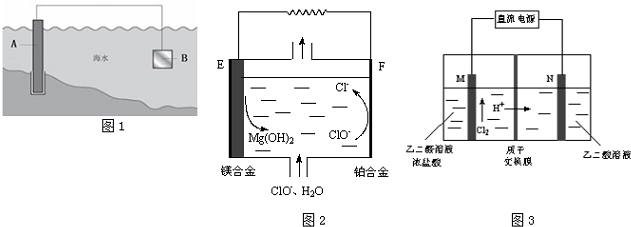
查看答案和解析>>
科目: 来源: 题型:解答题

| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
查看答案和解析>>
科目: 来源: 题型:解答题
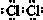 .
.
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验目的 | 试剂 |
| A | 验证Br2的氧化性强于I2 | 溴水、KI溶液、淀粉溶液 |
| B | 除去Fe2O3中的Al2O3 | 稀盐酸 |
| C | 检验Fe3O4溶于盐酸后的金属阳离子 | NaOH溶液 |
| D | 制备Fe(OH)3胶体 | 饱和FeCl3溶液、NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 为除去FeSO4溶液中的Fe2(SO4)3,可加入铁粉,再过滤 | |
| B. | SO2使溴水褪色,不能说明SO2具有漂白性 | |
| C. | HCl、NO2溶于水都有化学键断裂,但不全属于化学变化 | |
| D. | 为除去CO2中少量的SO2,可使其通过饱和Na2CO3溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 某条件下,在2L密闭容器中充入NO2发生如下反应:2NO2(g)?
某条件下,在2L密闭容器中充入NO2发生如下反应:2NO2(g)?查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 相同体积,PH值均为2的盐酸和醋酸分别与NaOH反应,消耗NaOH一样多 | |
| B. | pH=4的醋酸与PH=10的NaOH溶液等体积混合后,PH<7 | |
| C. | 将1 L 0.1 mol•L-1的Ba(OH)2溶液稀释为2 L,pH=12 | |
| D. | pH=8的NaOH溶液稀释100倍,其pH=6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com