
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
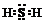 .
.| 操作 | 现象 |
| ①取B的溶液加入过量浓 NaOH溶液并加热 | 产生白色沉淀和无色刺激性气味气体; 过一段时间白色沉淀变为灰绿色,最终变为红褐色; |
| ②另取B的溶液, 加入过量BaCl2溶液 | 产生白色沉淀,加盐酸沉淀不溶解 |
查看答案和解析>>
科目: 来源: 题型:解答题
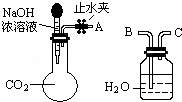 纯碱、烧碱等是重要的化工原料.
纯碱、烧碱等是重要的化工原料.| 实验操作 | 实验现象 | 结论 |
| ①取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | 产生白色沉淀 | 有CO32- |
| ②过滤,取2mL滤液于试管中 | ||
| ③滴加酚酞 | 溶液变红 | 有OH- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 由Ga与铝位于同一主族可知Ga既能与盐酸反应又能与氢氧化钠反应 | |
| B. | AsH3的稳定性弱于PH3 | |
| C. | Ga的原子序数比Ca大1 | |
| D. | 太阳能电池属于原电池 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2NaOH=Na2SiO3+H2O | |
| B. | 苯酚钠溶液中通入少量CO2:2 +CO2+H2O→2 +CO2+H2O→2 +HCO3- +HCO3- | |
| C. | 碳酸氢铵溶液中加入足量热的氢氧化钠溶液:NH4++OH-═NH3↑+H2O | |
| D. | “84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用时会放出氯气:ClO-+Cl-+2H+═Cl2↑+H2O |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2O2与水反应是水作还原剂的氧化还原反应 | |
| B. | 过氧化钠的电子式为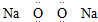 | |
| C. | 在过氧化钠与水的反应中,每生成0.1 mol氧气,转移电子的数目为0.4NA | |
| D. | 二氧化碳通过Na2O2粉末,反应后固体物质增重 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na+、Ca2+、Cl-、SO${\;}_{4}^{2-}$ | B. | Fe2+、H+、SO${\;}_{3}^{2-}$、ClO- | ||
| C. | K+、Fe3+、NO${\;}_{3}^{-}$、SCN- | D. | Mg2+、NH${\;}_{4}^{+}$、Cl-、SO${\;}_{4}^{2-}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com