
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
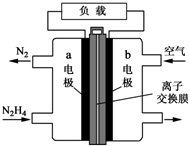 氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
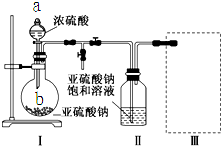 焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验: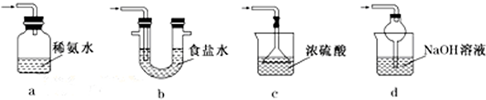
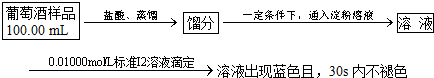
查看答案和解析>>
科目: 来源: 题型:选择题
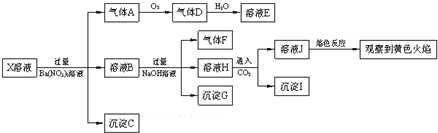
| A. | X中肯定存在Na+、Fe2+、A13+、NH4+、SO42- | |
| B. | 气体F在足量氧气中经催化氧化不可直接生成气体D | |
| C. | 沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I一定是Al(OH )3 | |
| D. | X中不能确定的离子是Fe2+、SO32-、K+和C1- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | “滴水石穿、绳锯木断”一定不涉及化学变化 | |
| B. | 明矾净水的原理和“84”消毒液消毒的原理不相同 | |
| C. | 充分开发利用天然纤维,停止使用各种化学合成材料 | |
| D. | 食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质 |
查看答案和解析>>
科目: 来源: 题型:选择题
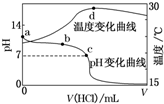 室温下,将1.000mol•L-1盐酸滴入20.00mL1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00mL1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | a点由水电离出的c(H+)=1.0×10-14 mol•L-1 | |
| B. | b点:c(NH${\;}_{4}^{+}$)+c(NH3•H2O)=c(Cl-) | |
| C. | c点:c(Cl-)=c(NH${\;}_{4}^{+}$) | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 物质 | △H(kJ/mol) |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| B. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 | |
| C. | 达到化学平衡时,4v正(O2)=5v逆(NO) | |
| D. | 化学反应速率关系是:2v正(NH3)=3v正(H2O) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com