
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
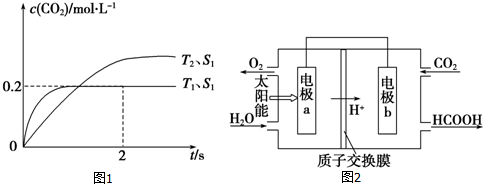
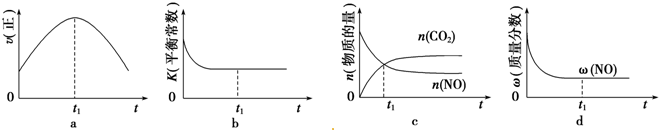
查看答案和解析>>
科目: 来源: 题型:解答题


 .
. ,G中官能团的名称为羧基和碳碳双键.
,G中官能团的名称为羧基和碳碳双键. .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
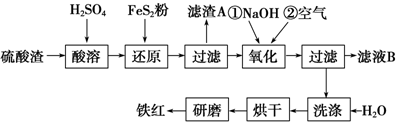
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目: 来源: 题型:解答题
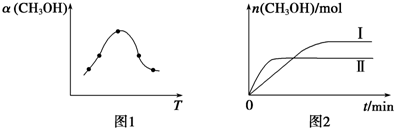
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原氨水的浓度为10-3 mol•L-1 | |
| B. | 溶液中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| C. | 氨水的电离程度增大,溶液中所有离子的浓度均减小 | |
| D. | 再加入10 mL pH=3的盐酸充分反应后混合液的pH值肯定等于7 |
查看答案和解析>>
科目: 来源: 题型:解答题
 (1)C、N、O三种元素第一电离能从大到小的顺序是N>O>C.
(1)C、N、O三种元素第一电离能从大到小的顺序是N>O>C.查看答案和解析>>
科目: 来源: 题型:解答题
| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||

查看答案和解析>>
科目: 来源: 题型:选择题
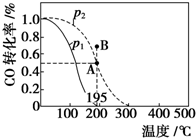 在20L的密闭容器中按物质的量之比为1:2充入CO和H2,发生:CO(g)+2H2(g)?CH3OH(g)△H.测得CO的转化率随温度及不同压强下的变化如图所示,p2和195℃时n(H2)随时间的变化结果如表所示.下列说法正确的是( )
在20L的密闭容器中按物质的量之比为1:2充入CO和H2,发生:CO(g)+2H2(g)?CH3OH(g)△H.测得CO的转化率随温度及不同压强下的变化如图所示,p2和195℃时n(H2)随时间的变化结果如表所示.下列说法正确的是( ) | t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
| A. | p1>p2,△H<0 | |
| B. | 在p2及195℃时,反应前3 min的平均速率v(CH3OH)=0.8 mol•L-1•min-1 | |
| C. | 在p2及195℃时,该反应的平衡常数为25 | |
| D. | 在B点时,v正>v逆 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com